
已知还原性Cl-<Fe2+<H2O2<I-<SO2,判断下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+2H++SO42-=SO2+O2+2H2O D.2Fe3++2I-=2Fe2++I2
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:阅读理解
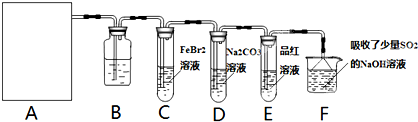
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:013
氰(CN)2、硫氰(SCN)2、氧氰(OCN)2与卤素单质相似被称为类卤化合物.已知有关阴离子的还原性强弱顺序为F-<OCN-<Cl-<Br-<CN-<SCN-<I-,结合已学知识,判断下列化学反应不可能发生的是
[ ]
A.4HSCN+MnO2 (SCN)2↑+Mn(SCN)2+2H2O
(SCN)2↑+Mn(SCN)2+2H2O
B.(CN)2+2NaBr=2NaCN+Br2
C.KSCN+KHSO4 HSCN↑+K2SO4
HSCN↑+K2SO4
D.NaCN+AgNO3=NaNO3+AgCN↓
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)CN·SCN与H2O___________________________________。
(2)CN·Br与NaOH溶液_______________________________。
(3)(SCN)2与KI溶液___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知几种阴离子还原性强弱顺序为F-<Cl-<Br-<I-<S2-。某溶液含有相同浓度的
F-、Cl-、Br-、I-、S2-,当向其中逐滴加入新制的饱和氯水直至过量时,最后被氧化的离子是 ( )
A. Br- B. Cl- C. F- D. S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com