
分析 根据均摊法计算晶胞中各原子个数,进而确定化学式;Mg原子处于顶点,与之最近的Ni原子处于面心,每个顶点为12面共用;在晶胞中,碳原子位于晶胞体心,只有1个C原子,镁位于顶点,晶胞中Mg原子数目为8×$\frac{1}{8}$=1,镍位于面心,每个镍原子被两个晶胞共用,故每个晶胞中镍原子个数为6×$\frac{(\;\;\;\;)}{(\;\;\;\;)}$$\frac{1}{2}$=3,根据$ρ=\frac{m}{V}$计算密度.
解答 解:碳原子位于晶胞体心,只有1个C原子,镁位于顶点,晶胞中Mg原子数目为8×$\frac{1}{8}$=1,镍位于面心,每个镍原子被两个晶胞共用,故每个晶胞中镍原子个数为6×$\frac{(\;\;\;\;)}{(\;\;\;\;)}$$\frac{1}{2}$=3,故晶体化学式为MgCNi3;
Mg原子处于顶点,与之最近的Ni原子处于面心,每个顶点为12面共用,故晶体中每个镁原子周围距离最近的镍原子有12个;
根据上面的计算可知,晶胞中含有1个C原子,1个Mg原子,3个镍原子,晶胞参数a=0.38nm=3.8×10-8cm,所以密度$ρ=\frac{\frac{12+24+59}{{N}_{A}}}{({3.8×1{0}^{-7})}^{3}}$g•cm-3=6.45g•cm-3,
故答案为:MgCNi3;12;6.45.
点评 本题考查晶胞结构与晶胞计算,需要学生具有一定的空间想象力,注意利用均摊法进行计算,难度不大.


科目:高中化学 来源: 题型:解答题
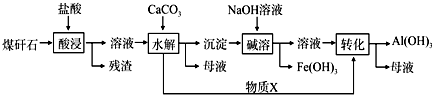
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O═4OH- | |
| C. | 将地下钢管与直流电源的正极相连,用来保护钢管 | |
| D. | 氢氧燃料电池中,氢气在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
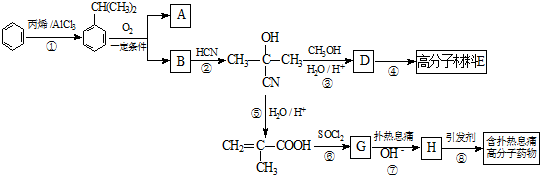
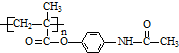 .
.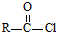
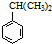 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
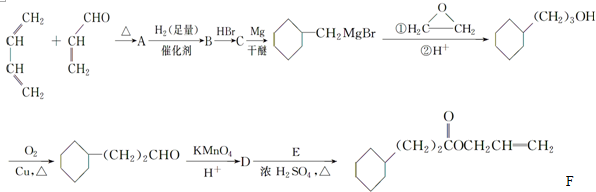
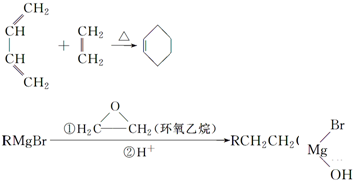

 .
. .
.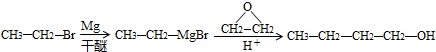 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
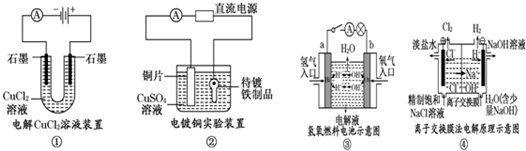
| A. | 装置①中阳极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中外电路电子由a极流向b极 | |
| D. | 装置④的阳极反应为:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂试剂或操作方法 |
| A | KNO3溶液 | KOH | 加入适量FeCl3溶液,过滤 |
| B | H2 | CO2 | 先后通过盛NaOH溶液、浓硫酸的洗气瓶 |
| C | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| D | FeSO4溶液 | CuSO4 | 加入过量铁粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com