
对于反应2SO2(g)+O2 (g) 2SO3(g),下列判断中正确的是( )
2SO3(g),下列判断中正确的是( )
A.2体积SO2和足量O2反应,生成 2体积SO3
B.恒温恒容,通入气体氦使压强增大,平衡向右移动
C.平衡时,SO2消耗速率等于O2生成速率的两倍
D.平衡时,SO2浓度等于O2浓度的两倍
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
2013年12月12日,中国矿业报报道中国地质科学院矿产综合利用研究所认定石龙铜矿含铜品位高(含铜3.27%)。已知铜矿物以黄铜矿、斑铜矿和辉铜矿为主。黄铜矿(CuFeS2)既是制取铜及其化合物的主要原料,又可以制备硫及铁的化合物。请回答下列问题:
(1)冶炼铜的反应方程式为8CuFeS2+21O2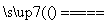 8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
8Cu+4FeO+2Fe2O3+16SO2↑,若CuFeS2中铁元素为+2价,则反应中被还原的元素为________(填元素名称)。
(2)上述冶炼过程中产生大量二氧化硫,下列对其性质的描述中正确的是________(填序号)。
A.SO2既是氧化剂,又是还原剂
B.SO2是还原产物
C.SO2是形成酸雨的一种物质
D.SO2是氧化产物
(3)SO2的存在对CO2的检验会造成干扰,实验室常用酸性高锰酸钾溶液除去SO2,请写出该反应的化学方程式:
_______________________________________________________________。
(4)利用黄铜矿冶炼产生的炉渣(含FeO、Fe2O3、SiO2、Al2O3)可制备Fe2O3。方法为先用稀盐酸浸取炉渣,过滤;将滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。用下列哪些试剂可以验证炉渣中含有FeO?________________(填序号)。其中发生氧化还原反应的离子方程式为____________________。
A.稀盐酸 B.稀硫酸 C.KSCN溶液
D.KMnO4溶液 E.NaOH溶液 F.碘水
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是(双选)( )
A.在1 L 0.1 mol·L-1的硫化钠溶液中,阴离子总数大于0.1NA
B.1 mol O2作氧化剂时转移电子数一定为4NA
C.1 mol硫酸钾固体中阴离子所带电荷数为2NA
D.在1 L 1.0 mol·L-1 NaCl溶液中含有NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如表所示:
| 检测序号 | 溶液中检测出的电解质溶液组合 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、AlCl3、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
则下列说法合理的是( )
A.三次检测结果都正确
B.该溶液中的阳离子无法判断
C.为了检验是否存在SO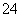 ,应先加过量稀硝酸后再滴加Ba(NO3)2溶液,观察是否有沉淀产生
,应先加过量稀硝酸后再滴加Ba(NO3)2溶液,观察是否有沉淀产生
D.为了检验是否存在CO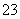 ,可以向溶液中滴加CaCl2溶液,观察是否有沉淀产生
,可以向溶液中滴加CaCl2溶液,观察是否有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
压强变化不会使下列化学反应的平衡发生移动的是( )
A.H2(g)+Br2(g)  2HBr (g) B.N2(g)+3H2(g)
2HBr (g) B.N2(g)+3H2(g)  2NH3(g)
2NH3(g)
C.2SO2(g)+O2(g)  2SO3(g) D.C(s)+CO2(g)
2SO3(g) D.C(s)+CO2(g)  2CO(g)
2CO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中A(g)+3B(g)  2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是( )
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是( )
A.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据
B.容器中混合气体的平均相对分子质量增大
C.正反应速率和逆反应速率都变小,C的百分含量增加
D.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中进行如下反应:2X(g)+Y(g)⇌2Z(g),若要使平衡时反应物总物质的量与生成物的总物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足( )
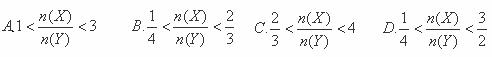
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液一定呈中性的是 )。
A.cH+)=cOH-)=10-6 mol·L-1的溶液
B.pH=7的溶液
C.使石蕊试液呈紫色的溶液
D.酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门实用性很强的学科,与社会发展的需要有密切的关系。下列说法中,不正确的是( )
A.用食醋可除去热水壶内壁的水垢
B.合成纤维和光导纤维都是新型无机非金属材料
C.酒精能使蛋白质变性,可用于杀菌消毒
D.误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com