
用CH4催化还原NOx可以消除氮氧化物的污染。已知CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)===2N2 (g)+CO2(g)+2H2O(g)
(g)+CO2(g)+2H2O(g)
ΔH=-1 160 kJ·mol-1。若在标准状况下4.48 L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
A.114.8 kJ B.232 kJ
C.368.8 kJ D.173.4 kJ
科目:高中化学 来源: 题型:
已知:Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s),ΔH=+234.1kJ••mol-1
CO2(g)+2Fe(s),ΔH=+234.1kJ••mol-1
C(s)+O2(g)=CO2(g);ΔH=-393.5kJ••mol-1
则2Fe(s)+ 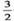 O2(g)=Fe2O3(s)的ΔH是( )
O2(g)=Fe2O3(s)的ΔH是( )
A、-824.4 kJ••mol-1 B、-627.6kJ••mol-1 C、-744.7kJ••mol-1 D、-169.4kJ••mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH =1的溶液中:K+、Fe2+、MnO
=1的溶液中:K+、Fe2+、MnO 、SO
、SO
B.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO 、SCN-
、SCN-
C.c(H+)/c(OH-)=1012的溶液中:NH 、Al3+
、Al3+ 、NO
、NO 、Cl-
、Cl-
D.与铝反应生成氢气的溶液中:NH 、K+、Cl-、SiO
、K+、Cl-、SiO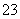
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ | Ag+ | Mg2+ | Cu2+ | Al3+ | NH |
| 阴离子 | Cl- | CO | NO | SO | SiO | I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是______。
( 2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈________性,原因是________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为_____________________________________________________
___________________________________________________________。
充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+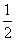 O2(g)===H2O(g) ΔH=-242 kJ/mol,断开1 mol O===O键和1 mol H—O键所吸收的能量分别为496 kJ和463 kJ,则断开1 mol H—H键所吸收的能量为( )
O2(g)===H2O(g) ΔH=-242 kJ/mol,断开1 mol O===O键和1 mol H—O键所吸收的能量分别为496 kJ和463 kJ,则断开1 mol H—H键所吸收的能量为( )
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g)
ΔH=-131.3 kJ/mol
③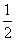 H2SO4(l)+NaOH(l)===
H2SO4(l)+NaOH(l)===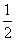 Na2SO4(l)+H2O(l)
Na2SO4(l)+H2O(l)
ΔH=-57.3 kJ/mo l
l
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
⑤CO(g)+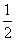 O2(g)===CO2(g) ΔH=-283 kJ/mol
O2(g)===CO2(g) ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l)
ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有________,不正确的理由分别是______________________________________________________________________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式
_________________________________________________________。
(3)上述反应中,表示燃烧热的热化学方程式有______________;表示中和热的热化学方程式有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示各装置的叙述中,正确的是( )
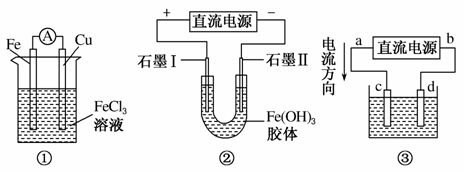
A.装置①是原电池,总反应是Cu+2Fe3+===Cu2++2Fe2+
B.装置①中,铁作负极,负极反应式为Fe3++e-===Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及 少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
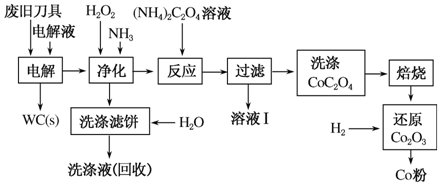
(1)电解时废旧刀具作阳极,不锈钢作阴极,HCl溶液为电解液。阴极主要的电极反应式为________。
(2)净化步骤所得滤饼的主要成分是________。回收的洗涤液代替水配制电解液,目的是回收利用其中的________。
(3)溶液Ⅰ的主要成分是________。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是______________。
(4)将Co2O3还原成Co粉的化学反应方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是制备CuO的流程图:
工业CuSO4
 CuSO4溶液
CuSO4溶液 CuSO4·5H2O—→……—→CuO
CuSO4·5H2O—→……—→CuO
(1)步骤Ⅰ的目的是除去不溶性杂质。操作是_________________________________。
(2)步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制 溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是___________________________
溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是___________________________
________________________________________________________________________。
(3)步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是_____________________________
____________________________________________________________(填操作名称),
过滤,水浴加热烘干。水浴加热的特点是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com