
【题目】下列关于胶体的说法正确的是
A.有人设想通过特殊的方法将碳酸钙加工成为纳米碳酸钙,纳米碳酸钙是与胶体相似的分散系
B.氢氧化铁胶体、葡萄糖溶液用激光笔照射,均能观察到一条光亮的通道
C.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
D.胶体的分散质粒子能通过滤纸
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】如图是一个化学反应过程的示意图.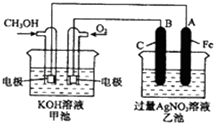
已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称.甲电池是装置,乙池是装置.
(2)请回答下列电极的名称:通入CH3OH的电极名称是 , B(石墨)电极的名称是 .
(3)写出电极反应式:通入O2的电极的电极反应式是 . A(Fe)电极的电极反应式为 ,
(4)乙池中反应的化学方程式为 .
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家规定,酿造食醋的总酸含量标准为3.5~5.0 g/100 mL(总酸含量即100 mL食醋中CH3COOH的质量).某化学兴趣小组为测定某市售食醋的总酸含量,进行了实验.实验后,得知10.0mL该食醋样品与7.5 g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应.计算该市售食醋样品中的总酸含量,并说明是否符合国家标准.(假设该市售食醋样品中其他物质不与氢氧化钠发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
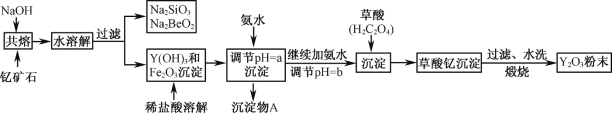
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | |
Fe3+ | 2.7 | 3.7 | |
Y3+ | 6.0 | 8.2 | |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在 范围内;继续加氨水调节pH =b发生反应的离子方程式为 ;检验Fe3+是否沉淀完全的操作方法是 。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3.nH2O]煅烧的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中。
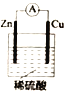
(1)锌片上的电极反应式为__________________。
(2)铜片上的现象是__________________。
(3)若反应过程中有0.2 mol电子发生转移,则生成的气体在标准状况下的体积为______________。
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_________(填序号)。
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列反应可以设计成原电池的是________(填字母代号)。
A. NaOH+HCl= NaCl+H2O B. 2H2+O2=2H2O
C. Fe+2FeCl3=3FeCl2 D. 2H2O=2H2↑+2O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算以下数值(均为25℃时)
(1)某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=
(2)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为
(3)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH最低为(已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
(4)①盐碱地因含较多的 ![]() ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式
②SOCl2是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将SOCl2与FeCl36H2O混合并加热,可得到无水FeCl3 , 得到无水FeCl3的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
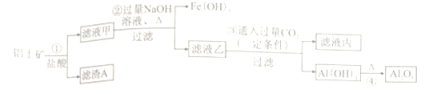
下列说法错误的是
A. 滤渣A主要成分为SiO2
B. 滤液乙含有的阴离子主要为[Al(OH)4]-、Cl-、OH-
C. 滤液丙中溶质的主要成分为Na2CO3
D. ④的基本反应类型为分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4 , ③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )
A.④>③>①=⑤>②
B.①=②>③>④>⑤
C.②>①>③>④>⑤
D.④>③>①>⑤>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有离子键、____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com