
分析 将总物质的量为n mol的钠和铝混合物投入一定量的水中充分反应,钠先与水反应生成氢氧化钠与氢气,铝再与氢氧化钠反应生成偏铝酸钠与氢气.反应的化学方程式为:2Na+2H2O═2NaOH+H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(1)x=0.5时,Al、Na的物质的量都为0.5nmol,根据反应Al+Na+2H2O═NaAlO2+2H2↑计算生成氢气的物质的量,然后根据V=nVm计算生成氢气体积;
(2)若金属剩余,剩余的为Al,则x<0.5;
(3)若金属无剩余,则说明钠过量或二者恰好反应,据此进行解答.
解答 解:(1)当x=0.5时,Na、Al的物质的量相等,都是0.5nmol,二者恰好发生反应:Al+Na+2H2O═NaAlO2+2H2↑,根据反应可知生成氢气的物质的量为:0.5nmol×2=nmol,标况下nmol氢气的体积为:22.4L/mol×nmol=22.4L,即V=22.4n,
故答案为:22.4n;
(2)由于钠与水反应,若金属有剩余,则剩余的金属为Al,根据反应可知Al+Na+2H2O═NaAlO2+2H2↑可知Na的物质的量小于0.5mol,即:0<x<0.5,
故答案为:0<x<0.5;
(3)若Na过量,即1>x>0.5,则有钠nxmol,铝n(1-x)mol,由方程式2Na+2H2O═2NaOH+H2↑可知,nxmol钠生成氢气0.5nxmol;由方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,n(1-x)mol铝生成氢气1.5n(1-x)mol,所以总共生成氢气的物质的量为:0.5nxmol+1.5n(1-x)mol=n(1.5-x)mol,生成氢气在不理想体积为:22.4n(1.5-x)L;
则根据上面的关系可知,所以钠越多生成气体总量越少,当即全是钠时,即x=1,生成氢气体积为11.2nL,
所以生成氢气体积范围为11.2nL<V≤22.4nL,
故答案为:11.2n<V≤22.4n.
点评 本题考查混合物的有关计算,题目难度较大,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
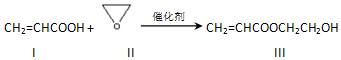
| A. | 化合物Ⅰ能与NaHCO3溶液反应生成CO2 | |
| B. | 可用Br2的CCl4溶液检验化合物Ⅲ中是否混有化合物I | |
| C. | 化合物Ⅱ与乙醛互为同分异构体 | |
| D. | 化合物Ⅲ水解可生成2种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5L 2mol/L盐酸中含有NA氯化氢分子 | |
| B. | 在标准状况下,2.24L氖气含有NA个电子 | |
| C. | 常温下,24gC2H518OH分子中含有3.5NA个共价键 | |
| D. | 若2H2S+O2═2S+2H2O生成3.2g硫,则反应过程中转移0.1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 结论 |
| A | 向溶液X 中加入稀盐酸和氯化钡的混合溶液, 出现白色沉淀 | 说明溶液X 中一定含有SO42- |
| B | 向盛有Fe(NO3)2溶液的试管中加入1mol•L-1 的H2SO4 | 若试管口出现红棕色气体,说明 NO3-被Fe2+还原为NO2 |
| C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸气 导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层. |
| D | 使用含 NaF 的牙膏,可以使牙齿上的 Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3 OH] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl(NH4Cl)用加热法分离 | B. | CO2(SO2)通过饱和的碳酸钠溶液洗气 | ||
| C. | NO(NO2)通过水洗气 | D. | Fe2O3(Al2O3)加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “滴水石穿、绳锯木断”涉及到化学变化 | |
| B. | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O同位素 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气是可再生的清洁能源,可用于工业制盐酸 | |
| B. | SiO2、MgO、Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 硝酸铵属于氧化剂,严禁用可燃物(如纸袋)包装 | |
| D. | 纤维素属于多糖类物质,但不能作人类的营养物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com