
【题目】利用下列装置和操作不能达到实验目的的是( )
|
|
|
|
A.从含碘CCl4溶液中提取碘和回收CCl4溶剂 | B.萃取操作过程中的放气 | C.定量测定化学反应速率 | D.比较KMnO4、Cl2、S的氧化性 |
A. A B. B C. C D. D
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g);ΔH =QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g);ΔH =QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.09 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是
A.m>n B. 温度不变,压强增大,Y的质量分数减少
C. Q<0 D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数小于20的四种元素,已知A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,B元素最高正价与负价的绝对值之差等于6.lmolC单质与足量的稀硫酸反应可生成1.5molH2 , 反应后C元素原子形成的离子和氖原子的电子层结构相同.D元素原子的最外层电子数是C元素原子的最外层电子数的2倍. 试回答:
(1)A,B,C,D四种元素依次是(写出元素名称).
(2)写出A与C、B与D最高价氧化物的水化物的化学式(按酸性或碱性由强至弱的顺序)
(3)写出A,C两元素最高价氧化物的水化物间反应的化学方程式
(4)请用电子式表示化合物A2O的形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是关于氯水的叙述,正确的是( )
A.新制氯水中只含C12和HClO分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡冒出,该气体为Cl2
D.氯水放置数天后,pH值将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向饱和食盐水中通入氯化氢,直至有白色固体析出,析出过程中叙述错误的是
A.白色固体是 NaClB.溶液中存在两种电离平衡
C.溶液 pH 值减小D.NaCl 的溶解速率小于结晶速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( ) 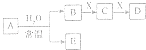
A.若X是Na2SO3 , C是能使品红溶液褪色的气体,则A可能是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH﹣+HCO3﹣═H2O+CO32﹣ 则E﹣定能还原CuO
C.若B,X均为单质,D为CO,C能和E反应,则E为NaOH
D.若D为白色沉淀,且与A的摩尔质量相等,则X一定是铝盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出). 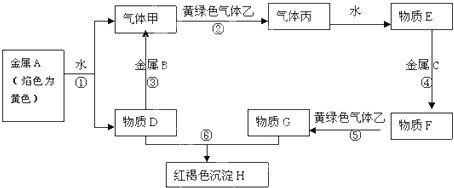
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:丙G
(2)写出下列反应的离子方程式: 反应①
反应⑤
(3)写出 乙+D的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H22NH3 | |||
起始浓度mol/L | 1.0 | 3.0 | 0 |
2秒末浓度mol/L | 0.6 | 1.8 | a |
A.0.2mol/(Ls)
B.0.4mol/(Ls)
C.0.6mol/(Ls)
D.0.8mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
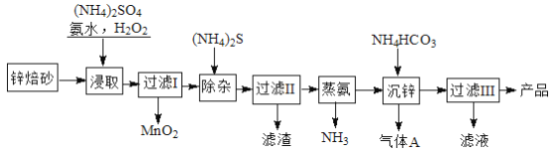
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com