
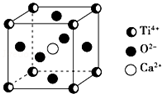
 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为236 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
分析 A.摩尔质量以g/mol为单位,数值上等于其相对分子质量;
B.Ti4+与体心的Ca2+相邻,每个Ti4+为8个晶胞共用;
C.每个Ti4+为8个晶胞共用,面心的O2-与之紧相邻,每个面心O2-为2个晶胞共用;
D.Ti4+与同一棱上的Ti4+相邻.
解答 解:A.CaTiO3的摩尔质量为136g/mol,其相对分子质量为136,故A错误;
B.Ti4+与体心的Ca2+相邻,每个Ti4+为8个晶胞共用,每个Ti4+与12个Ca2+紧相邻,故B错误;
C.每个Ti4+为8个晶胞共用,面心的O2-与之紧相邻,每个面心O2-为2个晶胞共用,晶体中与Ti4+相邻的O2-数目为$\frac{8×3}{2}$=12,故C正确;
D.Ti4+与同一棱上的Ti4+相邻,晶体中每个Ti4+与6个Ti4+紧相邻,故D错误.
故选:C.
点评 本题考查晶胞结构及有关计算,比较基础,注意掌握均摊法进行晶胞有关计算,可以利用补全晶胞进行观察,需要学生具备一定的空间想象.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:实验题
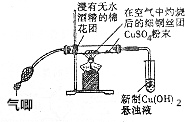 在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.
在完成“乙醇的催化氧化实验“后,某学校化学兴趣小组认为该实验方案存在着明显的缺点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
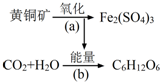 利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
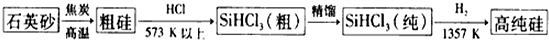
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
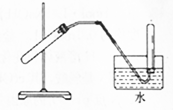
| A. | 用浓硫酸和铜制取二氧化硫 | B. | 用锌粒与稀硫酸反应制取氢气 | ||
| C. | 用氯化铵与氢氧化钙反应制取氨气 | D. | 用铜与浓硝酸反应制取二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
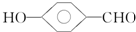 的沸点比
的沸点比 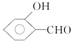 高,原因是
高,原因是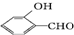 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为合成某种液晶材料的中间体M,有人提出如下不同的合成途径
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径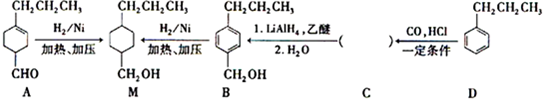
 ,由C→B反应类型为加成反应.
,由C→B反应类型为加成反应.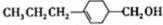 和
和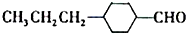 (写结构简式)两种互为同分异构体杂质生成.
(写结构简式)两种互为同分异构体杂质生成.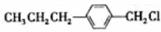 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$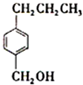 +NaCl;
+NaCl; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com