
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

| 2 |
| 3 |
| △c |
| △t |
| 2.2mol/L-1.9mol/L |
| 6min |


科目:高中化学 来源: 题型:
| A、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
| B、把金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| C、将少量二氧化碳气体通入澄清石灰水中:2OH-+CO2═CO32-+H2O |
| D、盐酸滴在石灰石上:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
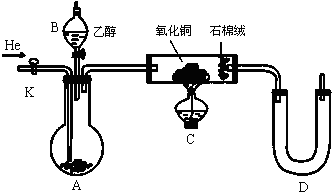
查看答案和解析>>
科目:高中化学 来源: 题型:
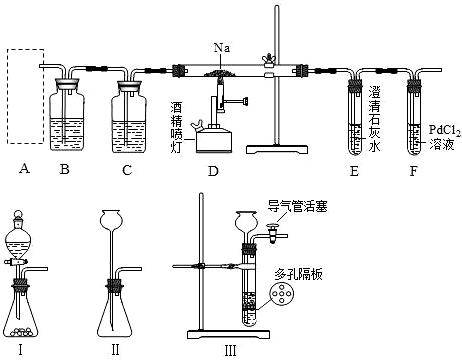
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是(双选)( )
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是(双选)( )| A、A分子属于酯类化合物,在一定条件下能发生水解反应 |
| B、A在一定条件下可与4 mol H2发生加成反应 |
| C、符合题中A分子结构特征的有机物只有1种 |
| D、与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
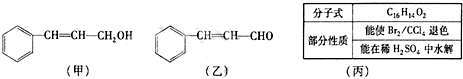
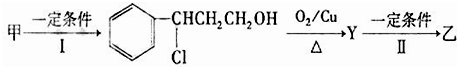
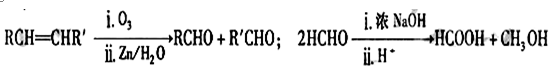
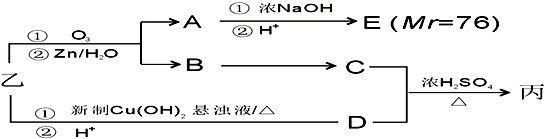
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com