
����Ŀ��ij��ѧ��ѧ��ȤС����ʵ�������ü�����������Ӧ��ȡ����Ʒ���ᣬ����Ƶ�װ�����£�
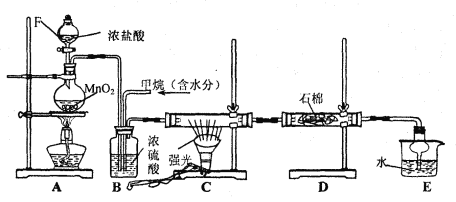
����Ҫ����գ�
(1) д��CH4��Cl2����һ�ȴ���Ļ�ѧ��Ӧ����ʽ ��
(2) Bװ�������ֹ��ܣ��������������٣����������Ͼ��ȣ���________________��
(3) Dװ���е�ʯ����������KI����Һ��KI��ĩ���������� ��
(4) Eװ�õ�������____________(����)��
A���ռ����� B����ֹ���� C���������� D�������Ȼ���
(5) Eװ���г��������������⣬�������л����E�з�����������ѷ���Ϊ ��
(6) ��װ�û���ȱ��,ԭ����û�н���β������,��β������Ҫ�ɷ���___________(����)��
A��CH3Cl B��CH2Cl2 C��CHCl3 D��CCl4 E��CH4
���𰸡�(1)CH4��Cl2��CH3Cl��HCl��(2)���������壻
(3)��ȥ������������(4)BD��(5)��Һ��(6)AE��
��������
�����������1���������������ȡ����Ӧ���䷴Ӧ����ʽΪ��CH4 �� Cl2 �� CH3Cl��HCl����2��Ũ����������ǿ����������١������Ͼ��ȡ��������壻(3)�����ж�������β�����������Dװ�õ������dz�ȥ������������(4)�Ȼ��⼫������ˮ��װ��E�������������Ȼ��⣬����ֹ��������ѡ��BD��ȷ��(5)�����������Ӧ����CH3Cl��CH2Cl2��CHCl3��CCl4�����к�����ΪҺ�壬�Ȼ��ⲻ�����л�����ֲַ㣬��˲��÷�Һ�ķ������з��룻(6)��û�д������Ǽ��飬Ӧ��ȼ��������ѡ��E��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£������백ˮ��ϣ�������ҺpH��7�������Һ�У� ��
A��c��NH4+����c��Cl-�� B��c��NH4+����c��Cl-��
C��c��NH4+����c��Cl-�� D����ȷ��c��NH4+����c��Cl-���Ĺ�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽĿ�ĵ���
A. �ÿɼ�����������������Һ�ͽ���
B. ��NH4Cl��Һ�����Ʊ�NH4Cl����
C. ����ȡ��Һ�ķ�����ȥ�ƾ��е�ˮ
D. ֻ�μӰ�ˮ����NaCl��A1Cl3��MgCl2��Na2SO4������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
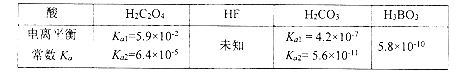
(1)Ϊ��֤��HF�����ᣬ�ס��ҡ�����λͬѧ�ֱ��������ʵ�����̽����
�� ��ͬѧȡһ�������HF��Һ������2 ����ɫʯ����Һ���Ժ�ɫ���ټ���NaF ����۲쵽��������__________________,��֤��HF Ϊ����.
�� ��ͬѧȡ10mlδ֪Ũ�ȵ�HF ��Һ������pH Ϊa ��Ȼ��������ˮϡ����1000mL ���ٲ���pH Ϊb ����Ҫ�϶�HF Ϊ���ᣬ��a ��b Ӧ����Ĺ�ϵ��b ��_____________(�ú�a �Ĵ���ʽ��ʾ)��
�� ��ͬѧ��pH ��ֽ���������0.10mol.L-1��HF ��Һ��pHΪ2 �����϶�HFΪ���ᣬ�ɱ�ͬѧ��ʵ�����ݿɵ�������HF �ĵ���ƽ�ⳣ��ԼΪ_______________.
(2)�� ��֪H3BO3 ��NaOH ��Һ��Ӧ�����ӷ���ʽΪH3BO3 +OH-��B(OH)4- ��д������ĵ��뷽��ʽ_____________________.
�� ���Ũ�ȵ�H2C2O4 ��H3BO3�����Һ����μ���NaOH ��Һ������OH- ���õ�����(�������Ӻ�����)����Ϊ_____________��______________��_____________��
(3)��NaHC2O4 ��Һ�м���������Na2CO3 ��Һ����Ӧ�����ӷ���ʽ_______________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���A��B��C��D��E�����л�����й���Ϣ��
A | B | C | D | E |
����һ��������ʹ������Ȼ�̼��Һ��ɫ ������ģ��Ϊ��
������ˮ��һ�������·�Ӧ����C | ����C��H����Ԫ����� �����ģ��Ϊ��
| �������Ʒ�Ӧ����������NaOH��Һ��Ӧ�� ������E��Ӧ������Է�������Ϊ100���� | ����C��H��Br����Ԫ����ɣ� ����Է�������Ϊ109 | ����C��H��O����Ԫ����ɣ� �����ģ��Ϊ��
|
���ݱ�����Ϣ�ش��������⣺
��1��д��Aʹ������Ȼ�̼��Һ��ɫ�Ļ�ѧ����ʽ��__________________��
��2��A�����������ӳɷ�Ӧ�����ɷ���F��F��ͬϵ���ͨʽΪCnH2n��2����n ��________ʱ�������л��↑ʼ��ͬ���칹�塣
��3��B�ķ���ʽΪ____________��д����Ũ���������£�B��Ũ���ᷴӦ�Ļ�ѧ����ʽ��___ ��
��4��C��E��Ӧ��������Է�������Ϊ100������д���÷�Ӧ�Ļ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯�ƹ�������ɽ�˶�Ա���õ���Դ�ṩ����ij��ȤС����ѡ������װ���Ʊ��⻯�ơ�
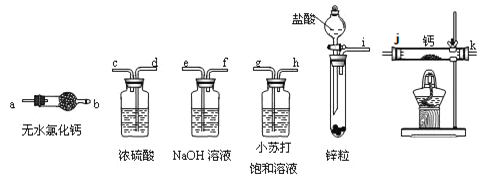
![]()
��ش��������⣺
��1����ѡ���Ҫ��װ�ã���������������˳��Ϊ____________���������ӿڵ���ĸ��ţ�
��2������������ʵ��װ�ý���ʵ�飬ʵ�鲽�����£����װ�������Ժ�װ��ҩƷ����Һ©������_________���밴��ȷ��˳���������в���ı�ţ���
A�����ȷ�Ӧһ��ʱ�� B���ռ����岢�����䴿��
C���رշ�Һ©������ D��ֹͣ���ȣ������ȴ
��3��ʵ�������ijͬѧȡ�������С�ļ���ˮ�У��۲쵽������ð������Һ�м����̪���Ժ�ɫ����ͬѧ�ݴ˶ϣ�����ʵ��ȷ��CaH2���ɡ�
��д��CaH2��ˮ��Ӧ�Ļ�ѧ����ʽ___________________
����ͬѧ���жϲ���ȷ��ԭ����_________________
��4���������һ��ʵ�飬�û�ѧ�������ָ����⻯�ƣ�д��ʵ���Ҫ���輰�۲쵽������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016���¿α�3������˵��������ǣ� ��
A����������������Ũ���ᷢ��ȡ����Ӧ
B����ϩ������������ʳƷ��װ���ϵ�ԭ��
C���Ҵ���������ˮ�е��ܽ�ȴ���������
D����������������Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�õ�������ע��Һ�������ǣ���ѧʽΪC6H12O6����ˮ��Һ�����ǩ�ϵIJ���������ͼ��ʾ�����ñ�ǩ���ṩ����Ϣ���ش��������⣺

��1��������Ħ������Ϊ ������̼���⡢������Ԫ�ص�������Ϊ ��
��2����ע��Һ�������ǵ����ʵ���Ũ��Ϊ mol/L��������λС������
��3��ʵ��������100mL ��Ũ�ȵ���������Һ��Ҫ��������ƽ��ȡ�����Ƿ�ĩ g��
��Ҫ����Ҫ������������Ͳ���ձ�����ͷ�ιܡ� �� �ȣ�
��4������˵������ȷ����_________������ţ���
��ʹ������ƿǰ������Ƿ�©ˮ
������ʱ���ӿ̶��ߣ�������ҺŨ��ƫ��
������ʱ��ˮ�����̶��ߣ���ˮ����һЩ�����¼�ˮ���̶���
�����ݺ�����ƿ������ʳָ��סƿ��������һֻ����סƿ�ף�������ƿ��תҡ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52gͭþ�Ͻ���ȫ�ܽ���50mL�ܶ�Ϊ1.40gmL��1����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������ 1 120mL����״��������Ӧ�����Һ�м���1.0molL��1NaOH��Һ������������ȫ������ʱ���õ�2.54g����������˵������ȷ���ǣ� ��
A���úϽ���ͭ��þ�����ʵ���֮����1��2
B����Ũ������HNO3�����ʵ���Ũ����14.0 molL��1
C��NO2��N2O4�Ļ�������У�NO2�����������80%
D���õ�2.54 g����ʱ������NaOH��Һ�������640 mL
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com