
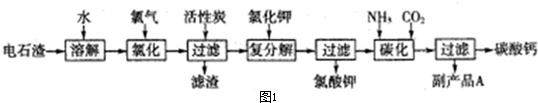
分析 以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙,电石渣加入水溶解,氢氧化钙和二氧化硅反应生成硅酸钙和水,氯气和碱反应温度控制在75~80℃生成氯酸钙、氯化钙和水,加入活性碳吸附过量的氯气,加入氯化钾发生复分解反应生成氯酸钾晶体,滤液中先向溶液中通入氨气,再通入CO2,碳化过滤得到碳酸钙和副产品滤液A为氯化铵;
(1)电石渣主要成分是Ca(OH)2,含SiO2等杂质,SiO2是酸性氧化物,都能与强碱Ca(OH)2反应;
(2)由题意可知后面产物有氯酸钾,所以前面的氯化反应产物应该有ClO3-;
(3)活性炭具有吸附作用;
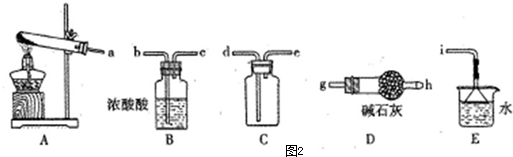
(4)①采用加热氯化铵和氢氧化钙混合物的方法制取氨气并收集纯净的氨气,依据装置图可知利用A发生装置制备氨气,气体中含有水蒸气,通过碱石灰干燥后采取向下排气法收集氨气,导气管短进长出,最后剩余氨气需要吸收防止污染空气,通过装置E吸收防止倒吸;
②浓氨水通过分液漏斗滴入固体氢氧化钠,氢氧化钠溶解放热,使一水合氨分解挥发得到氨气,氨气比空气轻用向下排空气法收集,注意导气管伸入试管底部;
(5)由碳化时通入NH3和CO2 二者在水中能生成CO32-和NH4+,CO32-再与Ca2+结合生成CaCO3沉淀,可知溶液中阳离子为NH4+,再根据前面几步可知阴离子主要是Cl-.
解答 解:以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙,电石渣加入水溶解,氢氧化钙和二氧化硅反应生成硅酸钙和水,氯气和碱反应温度控制在75~80℃生成氯酸钙、氯化钙和水,加入活性碳吸附过量的氯气,加入氯化钾发生复分解反应生成氯酸钾晶体,滤液中先向溶液中通入氨气,再通入CO2,碳化过滤得到碳酸钙和副产品滤液A为氯化铵;
(1)电石渣主要成分是Ca(OH)2,含SiO2等杂质,SiO2是酸性氧化物,都能与强碱Ca(OH)2反应,故反应方程式为Ca(OH)2+SiO2 =CaSiO3+H2O,
故答案为:Ca(OH)2+SiO2 =CaSiO3+H2O;
(2)由题意可知后面产物有氯酸钾,所以前面的氯化反应产物应该有ClO3-,故反应方程式为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,反应的离子方程式为:3Cl2+6OH-=ClO3-+5Cl-+3H2O,
故答案为:3Cl2+6OH-=ClO3-+5Cl-+3H2O;
(3)活性炭具有吸附作用,能吸附有毒气体Cl2,防止在后续实验中氯气逸出污染环境,故答案为:吸附氯气,防止在后续实验中氯气逸出污染环境;
(4)①采用加热氯化铵和氢氧化钙混合物的方法制取氨气并收集纯净的氨气,依据装置图可知利用A发生装置制备氨气,气体中含有水蒸气,通过碱石灰干燥后采取向下排气法收集氨气,导气管短进长出,最后剩余氨气需要吸收防止污染空气,通过装置E吸收防止倒吸,装置连接顺序为aghedi,
故答案为:g;h;e;d;防止倒吸;
②浓氨水通过分液漏斗滴入固体氢氧化钠,氢氧化钠溶解放热,使一水合氨分解挥发得到氨气,氨气比空气轻用向下排空气法收集,注意导气管伸入试管底部,所以最适合完成该实验的简易装置是A,
故答案为:A;
(5)由碳化时通入NH3和CO2 二者在水中能生成CO32-和NH4+,CO32-再与Ca2+结合生成CaCO3沉淀,可知溶液中阳离子为NH4+,再根据前面几步可知阴离子主要是Cl-,
故答案为:NH4Cl.
点评 本题以工艺流程图为依托,综合考查了几种金属和非金属化合物的性质,同时考查了离子反应,解题的关键是分析好流程图,注意前后呼应相互联系,题目难度中等.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 把一段打磨过镁带放入冷水中 | B. | 把铝条放入NaOH溶液中 | ||
| C. | 把绿豆大的钠投入到KCl溶液中 | D. | 把溴水滴加到淀粉KI溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管只用水洗 | |
| B. | 锥形瓶只用水洗 | |
| C. | 使用甲基橙做指示剂 | |
| D. | 第一次观察酸式滴定管的刻度时仰视 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
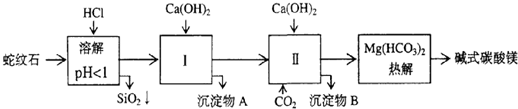
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com