
【题目】(1)已知:① C(s) + O2(g)=CO2(g) H=-393.5 kJmol-1
②2CO(g) + O2(g)=2CO2(g) H=-566 kJmol-1
③TiO2(s) + 2Cl2(g)=TiCl4(s) + O2(g) H=+141 kJmol-1
则TiO2(s) + 2Cl2(g) + 2C(s)=TiCl4(s) + 2CO(g)的H=_________________。
(2)氯化银在水中存在沉淀溶解平衡AgCl(s)![]() Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
(3)20 ℃时,0.1 molL-1 NH4Al(SO4)2溶液的pH=3,则:2c(SO42-)-c(NH4+)-3c(Al3+)≈______________molL-1(填数值)。
【答案】-80 kJmol-1 6×10-10 10-3
【解析】
(1)根据盖斯定律计算;
(2) 0.1 molL-1氯化铝溶液中,c(Cl-)=0.3mol/L,利用c(Ag+)= 计算;
计算;
(3)根据溶液呈电中性判断。
(1)根据盖斯定律,③+2×①-②,可得TiO2(s) + 2Cl2(g) + 2C(s)=TiCl4(s) + 2CO(g),H=+141+2×(-393.5)+ 566=-80 kJmol-1;
(2) 0.1 molL-1氯化铝溶液中,c(Cl-)=0.3mol/L,25℃时,氯化银的Ksp=1.8×10-10,则c(Ag+)= =6×10-10mol/L;
=6×10-10mol/L;
(3)根据溶液呈电中性可知,3c(Al3+)+ c(H+)+ c(NH4+)=2c(SO42-)+ c(OH-),2c(SO42-)-c(NH4+)-3c(Al3+)= c(H+)- c(OH-)=10-3-10-11≈10-3mol/L。


科目:高中化学 来源: 题型:
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂,它能将工厂排放的CO)以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充有Na2CO3溶液,其原理如图所示。

(1)这种微胶囊吸收CO2的原理是 ____用离子方程式表示),此过程是_____填“吸收”或“放出”)能量的过程。
(2)在吸收过程中下列关于胶囊内溶液的说法正确的是 ___(填字母)。
a.吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b.吸收过程中,体系中的含碳微粒只有CO32-、HCO3-、H2CO3
c.当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d.溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将解吸后的CO2催化加氢可制取乙烯。
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1
2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H3=_______________
(4)在体积为2L的恒容容器中发生反应:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)。当投料为1 mol CO2(g)和3molH2 (g)时,测得温度对CO2平衡转化率的影响为曲线a,改变投料比![]() 测量后得到曲线b。
测量后得到曲线b。
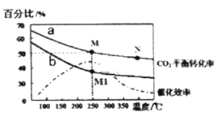
①根据曲线a计算250℃时该反应的化学平衡常数K= ____代入数值列出计算式即可)。
②b条件下投料比![]() ____(填“>” “<”或“=”)3,判断依据是 __ 。
____(填“>” “<”或“=”)3,判断依据是 __ 。
③下列说法正确的是 ___(填字母)。
A.平衡常数大小:M>N>M1
B.其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
C.当压强、混合气体的密度或![]() 不变时均可视为化学反应已达到平衡状态
不变时均可视为化学反应已达到平衡状态
D.工业生产中采取较高温度(250℃左右)是为了提高催化剂活性加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取10 mL 0.1 molL1某二元酸H2A,滴加0.1 molL1 NaOH溶液。已知:H2A=H+ + HA-,HA-![]() H+ + A2-。下列说法正确的是
H+ + A2-。下列说法正确的是
A.A2-可经过两步水解得到H2A
B.当用去NaOH溶液体积10 mL时,溶液中离子浓度大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当滴加至中性时,溶液中有c(Na+)=c(HA-) + c(A2-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=c(HA-) + c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )
A.遇甲基橙变红的溶液中:K+、Na+、Cl-、SiO32-
B.0.1molL-1NaA1O2溶液中:Na+、NO3-、NH4+、HCO3-
C.常温下,![]() =1012的溶液中:SO32-、SO42-、Na+、Br-
=1012的溶液中:SO32-、SO42-、Na+、Br-
D.澄清透明的溶液中:Fe3+、A13+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
①2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_____。
a 若混合气体密度保持不变,则已达平衡状态
b 达平衡后若再充人一定量CO2,平衡常数保持不变
c 分离出部分S,正、逆反应速率均保持不变,平衡不移动
d 从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通人2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
(2)利用CO、H2可制备天然气,主要反应为:
CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol1;
CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
回答下列问题:
①反应CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
②在恒压管道反应器中按n(H2):n(CO) = 3:1通入原料气,在催化剂作用下制备合成天然气,400 ℃ p总为100 kPa时反应体系平衡组成如下表所示:
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
则该条件下CO的总转化率α=____。![]()
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I :CH4(g) ![]() C(s) + 2H2(g) H = +75 kJ·mol-1;
C(s) + 2H2(g) H = +75 kJ·mol-1;
反应Ⅱ:2CO(g) ![]() C(s) + CO2(g) H = -172 kJ·mol-1,
C(s) + CO2(g) H = -172 kJ·mol-1,
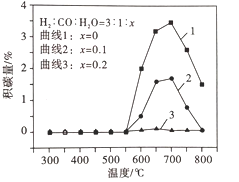
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是__。
A 曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B 曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C 曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D 水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉末(主要成分MnO2,还含有Al2O3、Fe2O3等杂质)为原料制MnSO4·H2O的工艺流程如下:
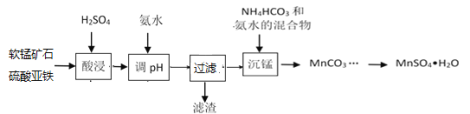
已知:pH>3.3后溶液不存在Fe3+,pH>5.0后溶液不存在Al3+,pH>8后Mn2+开始沉淀。
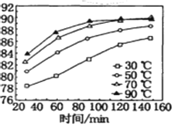
(1)保持其他条件不变,在不同温度下对含软锰矿粉进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。
(2)“酸浸”时,会将Fe2+氧化至Fe3+,所发生的反应离子方程式为__________。
(3)酸浸时要加入硫酸,硫酸浓度不能过大或者过小。当硫酸浓度过小时,酸浸会有红褐色残渣出现,原因是_____________________________。
(4)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。
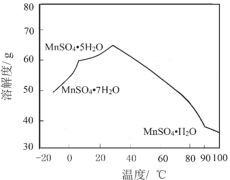
查看答案和解析>>
科目:高中化学 来源: 题型:
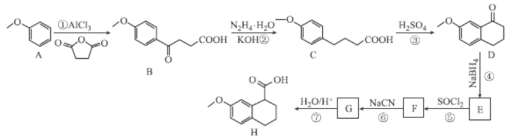
【题目】化合物H是C5a受体拮抗剂W-54011的中间体,Nakamura等人设计制备H的合成路线如图所示:
已知:Ⅰ. ;
;
Ⅱ.R-CN![]() R-COOH。
R-COOH。
回答下列问题:
(1)B中含氧官能团的名称为___。
(2)F的分子式为C13H13OCl,则F的结构简式为___。
(3)②⑤的反应类型分别为___、___。
(4)反应①的化学方程式为___。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,写出化合物H与足量H2发生加成反应的产物的结构简式___,并用星号(*)标出其中的手性碳:
(6)Q与C互为同分异构体,Q遇FeCl3溶液发生显色反应,且苯环上连有两个取代基,1molQ与足量NaHCO3溶液反应最多产生1molCO2,则Q的同分异构体有___种(不含立体异构)其中核磁共振氢谱有6组吸收峰的结构简式为___(任写一种)。
(7)参照上述合成路线和信息,设计以苯乙醛为原料(其它试剂任选),制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是( )
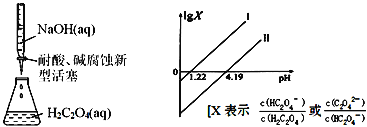
A.Ka2(H2C2O4)=10-4.19
B.直线Ⅰ中X=![]()
C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
D.Ⅰ、Ⅱ两条直线的斜率均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )


甲 乙
A. 各电池析出气体体积总数的变化B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加D. 各电极上放电的离子总数的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com