
| A. | HF | B. | NaHCO3 | C. | HCl | D. | NaHSO3 |
科目:高中化学 来源: 题型:选择题
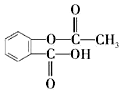
| A. | 乙酰水杨酸的分子式为C9H10O4 | |
| B. | 1mol乙酰水杨酸能与5molH2发生加成反应 | |
| C. | 1mol乙酰水杨酸在NaOH溶液中能与3mol NaOH反应 | |
| D. | 用烃基(-C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L Na2 SO4 | B. | 150ml 1.5mol/LKAl (SO4)2 | ||
| C. | 500ml 0.3mol/L Fe SO4 | D. | 50ml 3mol/L Fe2 (SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铁片插入CuSO4溶液中,验证古代湿法冶铜:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 某气体使澄清石灰水先变浑浊后变澄清,验证该气体是CO2:Ca2++2OH-+CO2═CaCO3↓+H2O、CaCO3+CO2+H2O═Ca2++2HCO3- | |
| C. | 在小苏打溶液中加入醋酸,验证醋酸比碳酸的酸性强:HCO3-+H+═CO2↑+H2O | |
| D. | 若要求用两种单质和一种溶液来测定Zn、Cu、Ag三种金属的活动性顺序,可用Zn、Cu和AgNO3:Zn+2Ag+═Zn2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
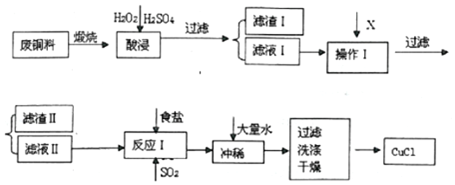
| 物质 | 开始沉淀pH | 沉淀完全pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.75 | 24.85 | 24.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中膜为阴膜(只允许阴离子通过),OH-从右往左通过该膜 | |
| B. | 电解时,阴极电极反应式为:2H++2e-═H2↑ | |
| C. | 电解时,如有3mol电子通过导线,则一定生成0.6mol KIO3 | |
| D. | 电池总反应为:KI+3H2O $\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com