
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
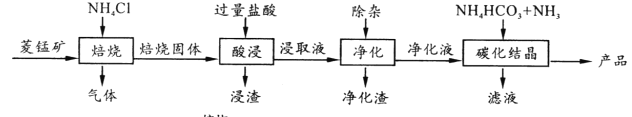
已知:MnCO3+2NH4Cl ![]() MnCl2+CO2↑+2NH3↑+H2O↑
MnCl2+CO2↑+2NH3↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
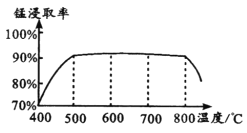
焙烧时适宜温度为_____;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160g于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH溶液至碱性,发生反应2Mn2++O2+4OH-=2MnO(OH)2;
II 加入过量KI溶液和适量稀H2SO4,发生反应:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
【答案】 500℃ 温度过高,NH4Cl分解导致与MnCO3的反应不彻底,使浸取率减小(或MnCO3分解发生其它副反应,使浸取率减小或MnCl2挥发导致Mn损失或高温下锰被氧化成高价态造成浸取率低或高温固体烧结,固体表面积减少等) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Fe(OH)3、Al(OH)3 Mn2++HCO3-+NH3==MnCO3↓+NH4+ 滴入最后一滴Na2S2O3溶液,溶液蓝色褪去且半分钟内颜色不复原 99.14%
【解析】(1)由图示得到,500℃的时候,锰的浸取率已经很大,所以选取500℃即可,没有必要选择更高的温度(因为温度越高,能耗越大)。温度很高时,浸取率下降,有可能是高温下氯化铵分解使反应的量减少(不是很好的答案,因为氯化铵分解的温度大约为337℃);可能是生成的氯化锰转化为气体离开体系(也不是很好,氯化锰沸点为1190℃);可能是高温下发生副反应,锰转化为其他化合物。
(2)①加入二氧化锰的目的是为了将Fe2+氧化为Fe3+,所以方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。
②物质中的杂质主要是Fe、Ca、Mg、Al等元素,因为步骤③中除去Ca2+、Mg2+,所以步骤②加氨水调pH,是为了除去Fe和Al元素,所以沉淀主要是Fe(OH)3、Al(OH)3。
(3)碳化结晶是向氯化锰溶液中加入碳酸氢铵和氨水,得到碳酸锰的固体,所以方程式为:Mn2++HCO3-+NH3==MnCO3↓+NH4+。
(4)①取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,此时溶液显蓝色,用硫代硫酸钠滴定单质碘,终点时,因为碘单质都被反应,所以溶液褪为无色,所以终点的现象为:滴入最后一滴Na2S2O3溶液,溶液蓝色褪去且半分钟内颜色不复原。
②根据滴定中的反应得到关系式:2Mn2+~2MnO(OH)2~2I2~4S2O32-。滴加的硫代硫酸钠为20×0.1÷1000=0.002mol,根据关系式Mn2+为0.001mol,因为是取1/10进行的滴定,所以Mn2+为0.01mol,所以氯化锰也是0.01mol,质量为115×0.01=1.15g,质量分数为1.15÷1.16=99.14%。


科目:高中化学 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机玻璃的单体分子(只含C、H、O元素)结构模型如图所示。下列分析正确的是
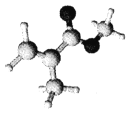
A. 该分子所有原子可能共面 B. 与该单体互为同分异构体的羧酸类有4种
C. 该有机高分子的链节为 D. 该有机玻璃容器可贮存强酸强碱溶液
D. 该有机玻璃容器可贮存强酸强碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大
A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
C | 与B同主族 |
D | 前四周期中金属性最强的元素 |
E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A. ①③⑤⑦⑧ B. ②④⑦ C. ①⑥ D. ②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种安全、高效的消毒剂,实验室制取二氧化氯的化学方程式如下:2NaClO3 + Na2SO3 + H2SO4 ![]() 2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是
2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是
A. NaClO3是还原剂 B. Na2SO3被氧化
C. NaClO3失去电子 D. H2SO4发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年,宿迁市成功创建为全国文明卫生城市,城市生态环境明显改善。
①下列做法不利于改善空气质量的是_________。
a.工厂通过静电除尘减少悬浮颗粒物排放
b.以新能源公交车代替燃油公交车
c.夜间排放工业废气
② 公共场所安装直饮水设备,方便市民饮用。直饮水需要经过活性炭处理、超滤膜过滤、紫外灯照射等处理过程。其中活性炭作为_________。
a. 混凝剂 b. 吸附剂 c.杀菌、消毒剂
③ 宿迁40余处“落叶景观带”成为扮靓城市的秋冬美景,为保护落叶景观带设置的“严禁烟火”标志是_________。

a b c
(2)红薯含有丰富的淀粉、膳食纤维、胡萝卜素、维生素A、B、C、E以及钾、铁、钙等多种营养成分,是一种营养均衡的保健食品。
① 红薯中含有的_________可有效改善牙龈出血。
a.维生素A b.维生素B c.维生素C
② 以上成分中,_________(填元素符号)为人体必需的微量元素。
③ 红薯中含有丰富的淀粉,其在人体内完全水解的最终产物是____(填化学式)。实验室检验该水解产物所用的试剂是_________。
④ 红薯不宜过多食用,否则会产生较多胃酸。双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它和胃酸反应的化学方程式为:__________。
(3)2017年,世界最长的跨海大桥——港珠澳跨海大桥正式通车。建造大桥使用了大量钢材、水泥、玻璃、光导纤维、橡胶等材料。

① 工业上生产水泥、玻璃都用到的原料是_________。
② 深埋在海水中的钢管桩易发生_______腐蚀,下列保护钢管桩的措施不合理的是________。
a.使用抗腐蚀性强的合金钢
b.在钢材表面喷涂防腐涂料
c.钢管桩附着铜以增强抗腐蚀性
③ 港珠澳大桥工程使用了大量密封橡胶衬垫。为使橡胶性能更好,天然橡胶需经过__________处理以增强其机械性能。
④ 光导纤维是由高纯度SiO2于2000℃下拉制而成,工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,该反应的化学方程式为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是

A.该反应的热化学方程式为 :A(g )+3B(g)![]() 2C(g);△H>0
2C(g);△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于pH=3的CH3COOH溶液的叙述正确的是
A. 溶液中H2O电离出的c(OH)=1.0×103 mol·L1
B. 加入少量CH3COONa固体后,溶液pH升高
C. 加0.1 mol·L1 CH3COONa溶液使pH>7,则c(CH3COO)=c(Na+)
D. 与等体积pH=11的NaOH溶液混合,所得溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com