


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、制普通玻璃的原料主要是纯碱、石灰石和石英 |
| B、玻璃在加热熔化时有固定的熔点 |
| C、普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅 |
| D、盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL 1 mol?L-1 NaCl溶液 |
| B、75 mL 1 mol?L-1CaCl2溶液 |
| C、150 mL 2 mol?L-1 KCl溶液 |
| D、75 mL 1 mol?L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、Ag2S沉淀溶解平衡表达式:Ag2S?2Ag++S2- |
| C、氢硫酸与硫酸铜反应:S2-+Cu2+=CuS↓ |
| D、NaHCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C(H+)?C(CH3COO-) |
| C(CH3COOH) |
| C(H+)?C(HS-) |
| C(H2S) |
| C(H+)?C(S2-)2- |
| C(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
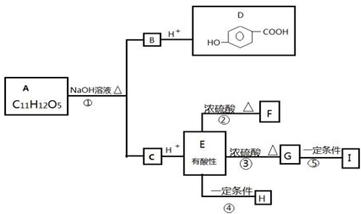
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷和乙烯 |
| B、甲烷和丙烯 |
| C、甲烷和丁烯 |
| D、乙烷和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究.请回答下列问题:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究.请回答下列问题:| 足量NaOH溶液 |
| 足量盐酸 |
| 足量盐酸 |
| 足量NaOH溶液 |
| 操作1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com