
| A. | NH3•H2O+HNO3→NH4NO3+H2O | B. | CH3COOH+KOH→CH3COOK+H2O | ||
| C. | H2SO4+Ba(OH)2→BaSO4↓+2H2O | D. | 2HCl+Ca(OH)2→CaCl2+2H2O |
分析 H++OH-=H2O表示表示强酸与强碱反应生成可溶性盐与水的离子反应,以此来解答.
解答 解:A.一水合氨在离子反应中保留化学式,离子反应为H++NH3•H2O=NH4++H2O,故A不选;
B.醋酸在离子反应中保留化学式,离子反应为CH3COOH+OH-=H2O+CH3COO-,故B不选;
C.硫酸钡在离子反应中保留化学式,离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C不选;
D.为强酸与强碱反应生成可溶性盐与水的离子反应,离子反应为H++OH-=H2O,故D选;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及离子方程式的意义,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I2互为同位素 | |
| B. | lmol碳酸钾晶体中含阴离子数为等于NA个 | |
| C. | 分子式为C4H8O2的羧酸共有3种 | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 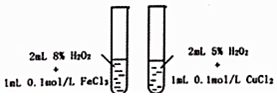 探究不同催化剂对H2O分解速率影响 | |
| B. | 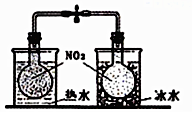 探究温度对2NO2?N2O2平衡影响 | |
| C. |  验证Cr2O72-+H2O?2CrO42-+H+平衡状态变化 | |
| D. |  验证钠和水反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成 SO3 为2 mol | |
| B. | 反应完全停止 | |
| C. | SO2 和 SO3物质的量之和为 2mol | |
| D. | SO2 的物质的量和SO3物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
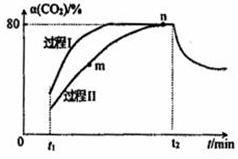 一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )
一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )| A. | m点:v(正)>v(逆) | |
| B. | 活化能:过程Ⅱ>过程I | |
| C. | n点时该反应的平衡常数K=50 | |
| D. | 过程I,t2时刻改变的反应条件可能是升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.
铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=2的硫酸溶液中,由水电离出的H+个数为10-12NA | |
| B. | 标准状况下,1.12L二氯甲烷含氯离子数为0.2NA | |
| C. | 向过量FeI2溶液中通入Cl2,当有1mol Fe2+被氧化时,转移的电子数为3NA | |
| D. | 2molNH3与3molO2在催化剂作用下加热充分反应后,所得NO分子数小于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com