
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)<Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,pH变化曲线如图丙所示(忽略温度变化),则①点c(CH3COO-)>c(Na+)>c(CH3COOH)
D. 图丁表示反应N2(g)+3H2(g)![]() 2NH3(g)平衡时NH3体积分数随起始
2NH3(g)平衡时NH3体积分数随起始![]() 变化的曲线,则转化率:αA(H2)=αB(H2)
变化的曲线,则转化率:αA(H2)=αB(H2)
【答案】C
【解析】A.由图像可知,当c(S2-)相同时,平衡时c(Cu2+)<c(Fe2+),则c(Fe2+)·c(S2-)>c(Cu2+)·c(S2-),根据Ksp(FeS)=c(Fe2+)·c(S2),Ksp(CuS)=c(Cu2+)·c(S2),则Ksp(FeS)>Ksp(CuS),故A错误;B.溶液中pH值与c(H+)间的关系为pH=-lgc(H+),溶液中c(H+)大,对应的pH值就小,当稀释弱酸时,随着水的加入,稀释可以促进弱酸的电离,但是总体来讲,溶液体积的增量超过溶液中H+的物质的量的增量,表现为溶液中c(H+)=![]() 减小,pH值增大;由于稀释促进弱酸的电离,因而在稀释相同倍数的弱酸时,对于酸性较弱的酸,能够促进其电离,增加了溶液中H+的量,也就表现为c(H+)会较酸性较强的弱酸大些,pH就较酸性较强的弱酸小些,因此总的来讲,酸性较强的弱酸稀释后对应的溶液pH值越大,从图像看出,甲酸的酸性是较乙酸强,即酸性甲酸>乙酸,故B错误;C.①点时加入10mL氢氧化钠溶液和醋酸反应,得到溶液中是等浓度的醋酸和醋酸钠的混合溶液,溶液呈酸性,以醋酸的电离为主,则c(CH3COO-)>c(Na+)>c(CH3COOH),故C正确;D.由图像可知,A与B状态时NH3的百分含量相等,对于有两种反应物参加的可逆反应,增加其中一种反应物的物料可使得另一种反应物的转化率增加;A状态时,
减小,pH值增大;由于稀释促进弱酸的电离,因而在稀释相同倍数的弱酸时,对于酸性较弱的酸,能够促进其电离,增加了溶液中H+的量,也就表现为c(H+)会较酸性较强的弱酸大些,pH就较酸性较强的弱酸小些,因此总的来讲,酸性较强的弱酸稀释后对应的溶液pH值越大,从图像看出,甲酸的酸性是较乙酸强,即酸性甲酸>乙酸,故B错误;C.①点时加入10mL氢氧化钠溶液和醋酸反应,得到溶液中是等浓度的醋酸和醋酸钠的混合溶液,溶液呈酸性,以醋酸的电离为主,则c(CH3COO-)>c(Na+)>c(CH3COOH),故C正确;D.由图像可知,A与B状态时NH3的百分含量相等,对于有两种反应物参加的可逆反应,增加其中一种反应物的物料可使得另一种反应物的转化率增加;A状态时, ![]() 值较小,可认为是增加了H2的量使得H2自身的转化率变小,B状态时,
值较小,可认为是增加了H2的量使得H2自身的转化率变小,B状态时, ![]() 值较大,可认为是增加了N2的量,从而提高了H2的转化率,转化率αA(H2)不一定等于αB(H2),故D错误;故选C。
值较大,可认为是增加了N2的量,从而提高了H2的转化率,转化率αA(H2)不一定等于αB(H2),故D错误;故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是

A. 1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)气体时,需要吸收5 kJ的能量
B. 2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时需要吸收12 kJ的能量
C. 1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D. I2(g)与H2(g)生成HI(g)气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:

下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
软锰矿还原浸出的反应为:12MnO2+ C6H12O6+ 12H2SO4=12MnSO4+ CO2↑+18H2O
①该反应中,还原剂为__________。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_____________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq)![]() Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)Fe(s)+CO2(g)△H>0
试回答下列问题:
(1)写出该反应的平衡常数表达式 .
(2)升高温度,该反应的平衡常数K值将(填“增大”、“减小”、“不变”),平衡体系中固体的质量将( 填“增大”、“减小”、“不变”).
(3)已知1100℃时该反应的平衡常数K=0.263.在该温度测得高炉中c(CO2)=0.025molL﹣1 , c(CO)=0.1molL﹣1 , 此时该的化学反应速度是v(正) (填“>”、“<”、“=”)v(逆).
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值(填”>”、“<”、“=”)0.263.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔.该元素最稳定的一种原子为 ![]() Md,关于该原子下列说法正确的是( )
Md,关于该原子下列说法正确的是( )
A.质子数是258
B.质量数是101
C.中子数是157
D.电子数是359
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁片和碳棒按图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装罝的说法,正确的是( )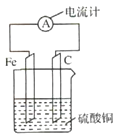
A.碳棒是正极
B.该装置能将电能转化为化学能
C.外电路中电流由铁片流出经过电流计流向碳棒
D.该装置的总反应为:2Fe+3Cu2+=2Fe3++3Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关核酸的功能的叙述,不正确的是 ( )
A.核酸是细胞内携带遗传信息的物质
B.DNA是大多数生物遗传信息的携带者
C.核酸在生物的遗传和变异中起重要作用
D.核酸是生物遗传信息的携带者,核酸中的碱基代表遗传信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关.下列叙述正确的是( )
A.鲜榨橙汁遇到碘水会变蓝
B.馒头越嚼越甜
C.油脂经水解可变成葡萄糖
D.土豆中的淀粉经水解可变成酒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com