
分析 (1)未被还原的硝酸生成硝酸铜,还原的硝酸生成NO或NO2或二者混合物,根据N元素守恒计算被还原的HNO3的物质的量;
(2)结合(1)中的关系式计算;
(3)1mol硝酸反应,反应中硝酸表现为酸性和氧化性,转移电子0.8mol,则应生成0.4molMg(N03)2,则应有0.2mol硝酸被还原,以此解答该题;
(4)设铁的化合价为+n价,因为a:b=l:3,则被还原的硝酸的物质的量为3-n,根据电子得失守恒,分析解答.
解答 解:(1)单质M与含b mol HNO3的溶液恰好完全反应,若M为Cu,未被还原的硝酸生成硝酸铜,还原的硝酸生成NO或NO2或二者混合物,根据N元素守恒,n(被还原HNO3)=n(总HNO3)-n(未被还原HNO3)=(b-2a)mol,故答案为:b-2a;
(2)n(总HNO3)=n(被还原HNO3)+n(未被还原HNO3)=$\frac{22.4L}{22.4L/mol}$+0.6 mol×2=2.2 mol,故答案为:2.2;
(3)1mol硝酸反应,反应中硝酸表现为酸性和氧化性,转移电子0.8mol,则应生成0.4molMg(N03)2,
如有0.2mol硝酸还原,则由0.2mol×(5-x)=0.8mol可知x=+1,应生成N2O,硝酸铵中氮的平均化合价为+1,如生成硝酸铵,则有0.1mol硝酸还原,由0.1mol×(5-y)=0.8mol可知y=-3,符合题意,所以硝酸的还原产物可能是N2O和NH4NO3,故答案为:N2O和NH4NO3;
(4)设铁的化合价为+n价,因为a:b=l:3,则被还原的硝酸的物质的量为3-n,根据电子得失守恒,即n=(3-n)×(5-2),解之得n=$\frac{9}{4}$,2<$\frac{9}{4}$<3,所以还原产物是Fe(N03)3和Fe(N03)2 的混合物,故选:C.
点评 本题考查氧化还原反应的计算,题目难度不大,注意把握硝酸的性质,从化合价的升降总数等于得失电子的总数的角度解答.


科目:高中化学 来源: 题型:选择题
| A. |  验证铁钉发生吸氧腐蚀 | |
| B. | 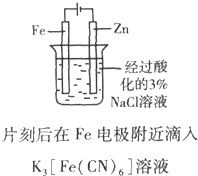 证明Fe电极被保护 | |
| C. | 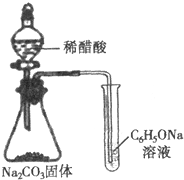 酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 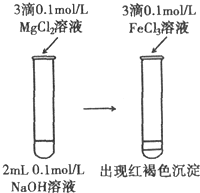 溶解度:Mg(OH)2>Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小压强 | B. | 缩小体积 | C. | 降低温度 | D. | 增大氢气的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
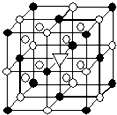 冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )
冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )| A. | Na+ | B. | Al3+ | C. | F- | D. | AlF6- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 用pH试纸测得某新制氯水的pH为2 | |
| C. | 有单质生成的反应一定为氧化还原反应 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有主族元素原子的最外层电子数都等于元素的最高正化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 第IA族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com