
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 25 |
| 2 |
| 25 |
| 2 |


科目:高中化学 来源: 题型:
| A、除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| B、电离能最小的电子能量最高 |
| C、同是s能级,在不同的电子层中所能容纳的最多电子数是不相同的 |
| D、核外电子排布完全相同的两种微粒,其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.0g | B、4g |
| C、4.7g | D、5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水中提取镁的过程中有用到硫酸 |
| B、工业炼铁中加入石灰石的目的是除去铁矿石中的杂质 |
| C、铁、铝常温下不能和浓硫酸、浓硝酸反应 |
| D、铝热反应特指铝与氧化铁的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素Y的气态氢化物比W的稳定 |
| B、元素Y的最高正价与负价绝对值的和等于8 |
| C、化合物XY2与ZY2分子中的化学键类型相同 |
| D、原子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
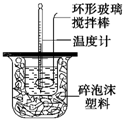 在量热器中将50ml、0.50mol?L-1CH3COOH溶液与50ml、0.55mol?L-1NaOH溶液混合,温度从25.16℃升高到27.46℃.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J?0C-1,C=4.18J?g-1?0C-1,溶液的密度为1g?cm-3.
在量热器中将50ml、0.50mol?L-1CH3COOH溶液与50ml、0.55mol?L-1NaOH溶液混合,温度从25.16℃升高到27.46℃.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J?0C-1,C=4.18J?g-1?0C-1,溶液的密度为1g?cm-3.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com