
| A、硝酸银 | B、氯化钠 |
| C、亚硫酸钠 | D、硫代硫酸钠 |


科目:高中化学 来源: 题型:
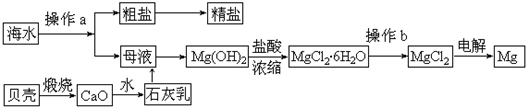
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液所用的容量瓶 |
| B、收集氨微喷泉实验所用的圆底烧瓶 |
| C、中和滴定实验中的酸式滴定管 |
| D、中和滴定实验中的锥形瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油、苯、乙醇都属于烃类物质 |
| B、含5个碳原子的有机物,分子中最多可形成5个碳碳单键 |
| C、等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 |
| D、苯和乙烯都能使溴水褪色,二者反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
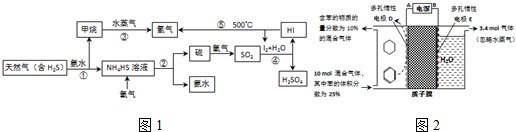
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
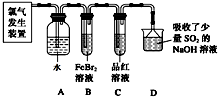
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl+2NH3?H2O→[Ag(NH3)2]Cl+2H2O |
| B、CuSO4+H2S→CuS↓+H2SO4 |
| C、KCl(l)+Na(l)→K↑+NaCl(l) |
| D、2[Ag(NH3)2]Cl+Na2S→Ag2S↓+2NaCl+4NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
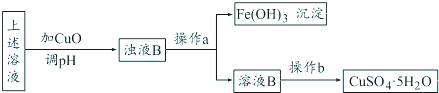
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LCH3OH含有的分子数等于0.1NA |
| B、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
| C、0.1 mol?L-1的碳酸钠溶液的pH大于0.1 mol?L-1的醋酸钠溶液的pH |
| D、3.4g NH3中含N-H键数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com