
 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.分析 (1)①同一周期元素从左到右电负性逐渐增大;
②CO在常温下为气态,符合分子晶体的性质;
(2)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构;
(3)①根据核外电子排布规律书写Cu原子的核外电子排布式,进而确定外围电子排布式;
②乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
③离子中存在配位键、C-N键、C-H键、N-H键、C-C键,据此判断离子化学键类型.
解答 解:(1)①同一周期元素从左到右电负性逐渐增大,故电负性C<O,故答案为:<;
②CO在常温下为气态,符合分子晶体的性质,所以CO固态时是分子晶体,故答案为:分子;
(2)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构,则[Cu(NH3)n]+中Cu+与2个氮原子形成配位键,故答案为:直线;2;
(3)①中心原子为Cu,Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故中心原子基态外围电子排布式为3d104s1;
故答案为:3d104s1;
②乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化.
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高.
故答案为:sp3;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
③离子中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD.
故答案为:ABD.
点评 本题考查原子结构与性质,为高频考点,把握杂化、配位键、电负性等为解答的关键,综合性较强,侧重分析与应用能力的考查,注意原子的电子排布及氢键应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
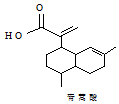
| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与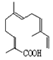 互为同分异构体 互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水应密闭保存,放置于低温处 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使气体颜色变深 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
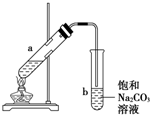
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 长玻璃导管只有导气的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,但反应的△H不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
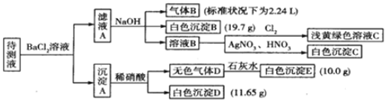
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
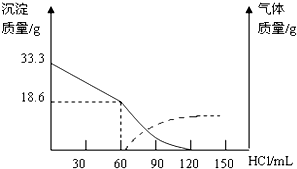
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com