
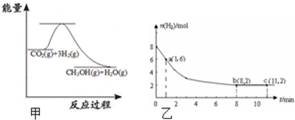
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.| △c(H2) |
| △t |
| △c(H2) |
| △t |
| ||
| 1min |
| 4mol |
| 2L |


科目:高中化学 来源: 题型:
| A、汽油燃烧产生的尾气中,含有碳的氧化物、氮的氧化物等污染物 |
| B、我国许多城市已经推广使用清洁燃料,如压缩天然气(CNG)类、液化石油气(LPG)类,这两类燃料的主要成分都是烃类 |
| C、光束通过下列分散系①有尘埃的空气②Fe(OH)3胶体③墨水④稀豆浆时,都能产生丁达尔效应 |
| D、114号元素在周期表中第七周期第ⅥA族,属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油、柴油和植物油都属于烃 |
| B、乙醇既能被氧化为乙醛,也能被氧化为乙酸 |
| C、苯与溴水在Fe3+催化下发生取代反应生成溴苯 |
| D、硫酸铜溶液和硫酸铵溶液均可使蛋白质溶液变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水结成冰体积膨胀,密度变小 |
| B、水加热到很高的温度都难以分解 |
| C、CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 |
| D、HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多量的CO2 |
| B、用0.1mol FeCl3配制成的1L溶液中,Fe3+的浓度为0.1mol?L-1 |
| C、用工业废弃物二氧化碳生产塑料,不会产生白色污染并有助于缓解温室效应 |
| D、工业生产硫酸中,建立高烟囱可以降低地面SO2的浓度,减少空气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com