
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) 2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H3
(1)△H3=__________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应Ⅰ。下列描述能说明反应Ⅰ达到平衡状态的是_____________(填序号).
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应Ⅱ在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:

此时,v正_________v逆 (填“>”、“<”或“=”),当反应达到平衡时,混合气体中CH3OH体积分数(CH3OH)%=_________%。
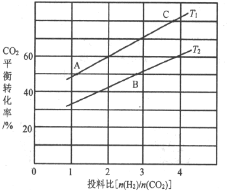
(4)反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=________;平衡常数K=_____(保留小数点后一位);KA、KB、KC三者之间的由大到小关系为______。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=![]() ×100%
×100%
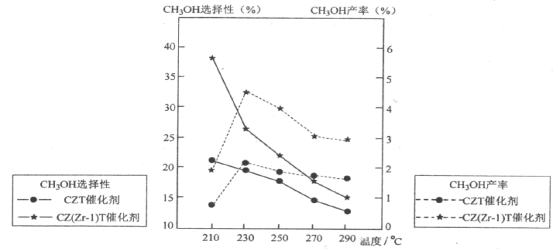
①温度高于230°C,CH3OH产率随温度升高而下降的原因是_______________。(答一条即可)
②在上述条件下合成甲醇的工业条件是___________________。
A.210°C B.230°C C.催化剂CZT D.催化剂CZ(Zr-1)T
【答案】-122.6 AC > 20 0.18mol·L1·min1 263.7 KA=KC>KB 反应I的△H<0,温度升高,平衡逆向移动,使CO2转化为CH3OH的平衡转化率下降; BD
【解析】
(1)根据盖斯定律可知,反应Ⅰ×2-反应ⅠⅠ=反应ⅠⅠⅠ,故△H3=[(-49.6)×2-23.4] kJ/mol=-122.6 kJ/mol,
故答案为:-122.6;
(2)反应Ⅰ正向为气体体积减小的放热反应,
A、恒温恒容条件下,气体物质的量之比等于其压强之比,该反应正向气体物质的量减小,当容器内总压不变时,气体物质的量不变,可说明反应达到平衡状态,故A符合题意;
B、该反应为全气体反应,反应过程中气体质量不变,反应是在恒容容器中进行,故气体密度始终不变,则不能判断反应是否达到平衡状态,故B不符合题意;
C、水分子中断裂2NA个H-O键,即消耗1mol水,同时氢分子中断裂3NA个H-H键,即消耗3mol氢气,反应方向不同,物质消耗之比等于其计量数之比,说明正逆反应速率相等,故可说明反应达到平衡状态,故C符合题意;
D、CH3OH和H2O均为生成物,二者系数均为1,起始浓度均为0,故任意时刻二者的浓度之比均不变,故无法说明反应达到平衡状态,
故答案为AC;
(3)该时刻的浓度熵Qc=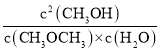 =
=![]() =
=![]() <0.25,故该反应正向进行,故v正>v逆;设从该时刻至平衡时,H2O(g)转化浓度为xmol/L,则
<0.25,故该反应正向进行,故v正>v逆;设从该时刻至平衡时,H2O(g)转化浓度为xmol/L,则
CH3OCH3(g)+H2O(g)![]() 2CH3OH(g)
2CH3OH(g)
起始(mol/L) 1.8 1.8 0.4
转化(mol/L) x x 2x
平衡(mol/L) 1.8-x 1.8-x 0.4+2x
由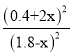 =0.25可解得x=0.2,n总=4mol,混合气体中CH3OH体积分数(CH3OH)%=
=0.25可解得x=0.2,n总=4mol,混合气体中CH3OH体积分数(CH3OH)%=![]() ×100%=20%,
×100%=20%,
故答案为:>;20;
(4)由图象可知,在T1温度下,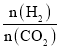 =2时,CO2平衡转化率为60%,在5min后反应处于平衡状态,故0~5min内
=2时,CO2平衡转化率为60%,在5min后反应处于平衡状态,故0~5min内![]() =
=![]() =1.8mol/L,则
=1.8mol/L,则![]() =0.9mol/L,故0~5min内的平均反应速率v(CH3OCH3)=
=0.9mol/L,故0~5min内的平均反应速率v(CH3OCH3)=![]() =
=![]() = 0.18mol·L1·min1;根据转化量之比等于其其系数之比可知,平衡时,c(CO2)=1.2mol/L、c(H2)=0.6mol/L、c(CH3OCH3)=0.9mol/L、c(H2O)=2.7mol/L,则K=
= 0.18mol·L1·min1;根据转化量之比等于其其系数之比可知,平衡时,c(CO2)=1.2mol/L、c(H2)=0.6mol/L、c(CH3OCH3)=0.9mol/L、c(H2O)=2.7mol/L,则K=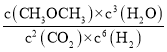 =
=![]() =263.7;相同投料比下达到平衡时,CO2平衡转化率T1>T2,故T1温度下的衡常数大于T2温度下平衡常数,根据温度不变,平衡常数不变可知,KA=KC>KB,
=263.7;相同投料比下达到平衡时,CO2平衡转化率T1>T2,故T1温度下的衡常数大于T2温度下平衡常数,根据温度不变,平衡常数不变可知,KA=KC>KB,
故答案为:0.18mol·L1·min1;263.7;KA=KC>KB;
(5)①由图象可知,在230℃之前,反应还未达到平衡状态,在230℃之后,反应达到平衡状态,而反应I正向为放热反应,升高温度,平衡逆向移动,使CH3OH产率下降,
故答案为:反应I的△H<0,温度升高,平衡逆向移动,使CO2转化为CH3OH的平衡转化率下降;
②由图象可知,合成甲醇最佳条件为230℃下,在230℃下CZT催化剂对甲醇的选择性低于CZ(Zr-1)T催化剂,由此可知,最佳催化剂为CZ(Zr-1)T催化剂,
故答案为:BD。


科目:高中化学 来源: 题型:
【题目】根据下表提供的数据,下列判断正确的是![]()
化学式 | 电离常数 |
HF |
|
|
|
| |
HClO |
|
A.同温同浓度下,溶液的pH值:![]()
B.结合![]() 的能力:
的能力:![]()
C.碳酸钠溶液中加入少量氢氟酸的离子方程式:![]()
D.次氯酸钠溶液中通入少量二氧化碳的离子方程式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应A(g)+3B(g)![]() 2C(g)+2D(g)中,反应速率最快的是
2C(g)+2D(g)中,反应速率最快的是
A.υ(A)=0.02mol/(Ls)B.υ(B)=0.04 mol/(Ls)
C.υ(C)=1.2mol/(Lmin)D.υ(D)=1.8mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,2molX和2molY进行如下反应:2X(g)+Y(g)Z(g),经2min达到平衡,生成0.6molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.06mol/(Lmin)
B.将容器体积变为20L,Z的平衡浓度为原来的![]()
C.平衡时,X的转化率为30%
D.起始状态和平衡时容器内的气体压强比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,其电池总反应为:2CH2=CH2+O2→2CH3CHO。下列说法错误的是( )
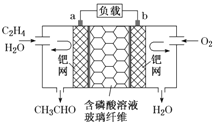
A.该电池可将化学能转化为电能B.正极区溶液的pH增大
C.负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+D.每有0.1 mol O2反应,则溶液中迁移0.4 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:
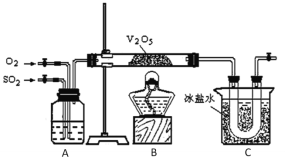
(1)已知450℃时,反应2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)
2SO3(g)的平衡常数K=25,则在450℃时,2SO3(g)![]() 2SO2(g)+O2(g)的化学平衡常数为___。
2SO2(g)+O2(g)的化学平衡常数为___。
(2)A中的试剂是___。
(3)在实验过程中不必持续加热,说明该平衡的△H___0(填“>”或“=”或“<”),C装置用来收集三氧化硫,其中冰盐水的作用是___;若用32g铜跟足量浓硫酸反应制取二氧化硫,实验结束时得到20g三氧化硫,该实验中二氧化硫的转化率不小于___。
(4)请指出本套实验装置的明显缺陷是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol![]() 和2mol
和2mol![]() ,开始时容器的体积均为VL,发生如下反应并达到平衡状态
,开始时容器的体积均为VL,发生如下反应并达到平衡状态![]() 提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)
提示:物质X,Y的状态均未知,物质Z的状态为气态),2X(?)+Y(?)![]() aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)此时Ⅰ中X,Y,Z的物质的量之比为1:3:2。下列判断正确的是![]()
![]()
Ⅰ Ⅱ
Ⅱ Ⅲ
Ⅲ
A.物质Z的化学计量数 a= 2
B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现资源利用最大化,某化工厂将合成氨、制纯碱和生产尿素![]() 工艺联合,简易流程如下:
工艺联合,简易流程如下:
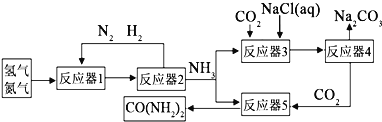
![]() 时101kPa时,测得生成17g
时101kPa时,测得生成17g![]() ,放出
,放出![]() 热量,写出合成
热量,写出合成![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
![]() 合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
![]() 反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______
反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______ ![]() 向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得
向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得![]() 反应器3中的化学方程式为 ______ .
反应器3中的化学方程式为 ______ .
![]() 工业上可用碳、甲烷与水蒸汽反应制氢气
工业上可用碳、甲烷与水蒸汽反应制氢气
![]() ,
,![]() ,此反应的化学平衡常数表达式为
,此反应的化学平衡常数表达式为![]() ______ ,为了提高碳的转化率,宜采用下列措施中的
______ ,为了提高碳的转化率,宜采用下列措施中的![]() 填字母编号
填字母编号![]() ______ .
______ .
A.增大压强![]() 增加碳的量
增加碳的量![]() 升高温度
升高温度![]() 增加水的量
增加水的量![]() 使用催化剂
使用催化剂![]() 及时移出CO、
及时移出CO、![]()
![]() 有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
![]() 若仅以
若仅以![]() 、空气、
、空气、![]() 为原料制尿素
为原料制尿素 ,标准状况下
,标准状况下![]()
![]() ,理论上最多能制 ______
,理论上最多能制 ______ ![]() 尿素.
尿素.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com