
| A. | V(NH3)=0.6mol/(L•S) | B. | V(O2)=0.7mol/(L•S) | C. | V(NO)=0.5mol/(L•S) | D. | V(H2O)=0.8mol/(L•S) |
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:实验题
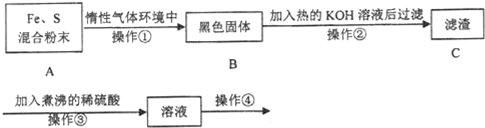
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
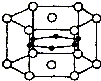 图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.
图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏产物主要成分是碳氢化合物 | |
| B. | 工业上可通过石油的裂解获得大量乙烯 | |
| C. | 重油经过裂化可以得到汽油 | |
| D. | 煤中含有苯、甲苯,可用分馏的方法将它们分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其化合物的种类最多且其氢化物是一种清洁能源 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧的生成物是过氧化钠 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 熔沸点随原子序数增加而升高 | |
| D. | 碱金属单质还原性随原子电子层数的增加而增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com