
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为
1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
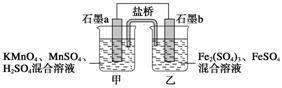
回答下列问题:
(1)此原电池的正极是石墨__________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为
甲________________________________________________________________________;
乙________________________________________________________________________。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
答案 (1)a 还原
(2)乙
(3)MnO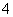 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
5Fe2+-5e-===5Fe3+
(4)0.5
解析 (1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极。(2)电池工作时,SO 向负极移动,即向乙烧杯移动。(3)甲烧杯中的电极反应式为MnO
向负极移动,即向乙烧杯移动。(3)甲烧杯中的电极反应式为MnO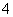 +5e-+8H+===Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-===5Fe3+。(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,转移的电子为0.1 mol×5=0.5 mol。
+5e-+8H+===Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-===5Fe3+。(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,转移的电子为0.1 mol×5=0.5 mol。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
苯佐卡因是一种局部麻醉剂,可用于黏膜溃疡、创面等的镇痛,一般制成软膏或栓剂使用,它的工业合成有如下所示的两种途径。途径Ⅰ已被逐渐淘汰,现在使用较多的是途径Ⅱ。
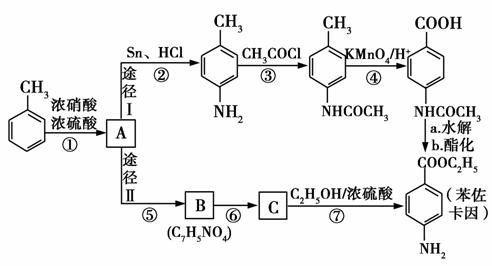
已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
②苯胺( )分子中的氨基易被氧化。
)分子中的氨基易被氧化。
请回答下列问题:
(1)反应①的反应类型为________,化合物B的结构简式为________。
(2)反应⑦的化学方程式为_________________________。
(3)下列关于上述合成路线的说法正确的是________。
a.反应①除了主要生成A物质外,还可能生成 等;
等;
b.途径Ⅱ中的步骤①和⑤可以互换;
c.反应③的另一产的是H2O;
d.与途径Ⅱ相比,途径Ⅰ的缺点是步骤多,产率低;
e.途径Ⅰ中的步骤③的目的是保护氨基不被步骤④中的KMnO4酸性溶液氧化。
(4)途径Ⅱ中的步骤⑤和⑥能互换吗?________,理由是
___________________________________________________。
(5)苯佐卡因有多种同分异构体,其中有2个对位取代基,—NH2直接连在苯环上,分子结构中含有酯基的同分异构体有: 、
、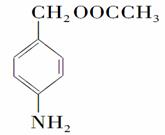 、________、________。
、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法:
(1)酸性条件
燃料电池总反应式:CH4+2O2===CO2+2H2O ①
燃料电池正极反应式:O2+4H++4e-===2H2O ②
①-②×2,得燃料电池负极反应式:________________________________________
________________________________________________________________________。
(2)碱性条件
燃料电池总反应式:CH4+2O2+2NaOH===Na2CO3+3H2O ①
燃料电池正极反应式:O2+2H2O+4e-===4OH- ②
①-②×2,得燃料电池负极反应式:_______________________________________
________________________________________________________________________。
(3)固体电解质(高温下能传导O2-)
燃料电池总反应式:CH4+2O2===CO2+2H2O ①
燃料电池正极反应式:O2+4e-===2O2- ②
①-②×2,得燃料电池负极反应式:______________________________________
________________________________________________________________________。 (4)熔融碳酸盐(如:熔融K2CO3)环境下
电池总反应式:CH4+2O2===CO2+2H2O ①
正极电极反应式:O2+2CO2+4e-===2CO ②
②
①-②×2,得燃料电池负极反应式:_______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应没有涉及原电池的是 ( )
A.生铁投入稀盐酸中
B.铜片与银片用导线连接后,同时插入FeCl3溶液中
C.纯锌投入硫酸铜溶液中
D.含铜的铝片投入浓硫酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是 ( )

A.光伏发电是将太阳能转变为电能
B.上图中N区半导体为负极,P区半导体为正极,电流从a流向b
C.YAG中钇显+3价
D.Ga与N在元素周期表中不处于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A. N2H4+
N2H4+ O2===
O2=== N2+H2O ΔH=-267 kJ·mol-1
N2+H2O ΔH=-267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用铁片与10mL0.1mol·L-1硫酸反应制取氢气时,下列措施中不能使氢气生成速率加快的是
A.加热 B.加入10mL0.1mol·L-1硫酸
C.滴加少量CuSO4溶 液 D.不用铁片,改用铁粉
液 D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学键与晶体结构说法正确的是
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于范德华力的叙述中,正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键
B.任何分子间在任意情况下都会产生范德华力
C.范德华力与化学键的区别是作用力的强弱问题
D.范德华力非常微弱,故破坏范德华力不需要消耗能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com