
| A. | 1:1:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
分析 可溶性氯化物和AgNO3溶液反应离子方程式为Ag++Cl-=AgCl↓,完全沉淀等体积、等物质的量浓度的AgNO3溶液,则消耗n(Cl-)相等,根据n=CV及化学式中氯离子个数计算需要三种盐溶液体积.
解答 解:可溶性氯化物和AgNO3溶液反应离子方程式为Ag++Cl-=AgCl↓,完全沉淀等体积、等物质的量浓度的AgNO3溶液,则消耗n(Cl-)相等,NaCl、MgCl2、AlCl3溶液的物质的量浓度相等,根据n=CV及化学式知,需要三种盐溶液体积之比=$\frac{n(C{l}^{-})}{1}$:$\frac{n(C{l}^{-})}{2}$:$\frac{n(C{l}^{-})}{3}$=6:3:2,故选C.
点评 本题考查化学方程式有关计算,为高频考点,可以利用方程式计算也可以利用关系式计算,明确所需氯离子的物质的量相等是解本题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O | |
| B. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 硫化钠的水解:S2-+H2O?HS-+OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1:1 | B. | 2:2:1:2 | C. | 1:3:1:1 | D. | 4:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
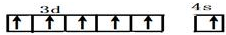 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br-、Cl-、I- | B. | Cl-、I-、Br- | C. | I-、Br-、Cl- | D. | Br-、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解氯化镁溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$-H2↑+Cl2↑+2OH- | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2=2NH4++SO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑦ | B. | ①②③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:2 | D和E 1:3 | B和E 1:4 |
 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com