
| 2mol×17g/mol |
| 6.8g |
| 5-1×3 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
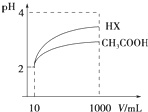 (1)常温下0.1mol?L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
(1)常温下0.1mol?L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
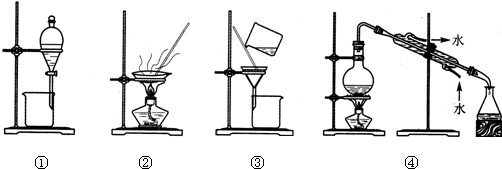
| A、分离乙酸乙酯和碳酸钠溶液,选① |
| B、用CC14提取碘水中的碘,选② |
| C、分离NaCl溶液和沙子,选③ |
| D、用自来水制取蒸馏水,选④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g Na2O2中含有的离子总数为0.4 |
| B、1 mol FeCl3制成胶体,所得胶体粒子数目为NA |
| C、pH=13的氢氧化钠溶液中所含Na+为0.1NA |
| D、5.6 g铁与足量的盐酸反应失去电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
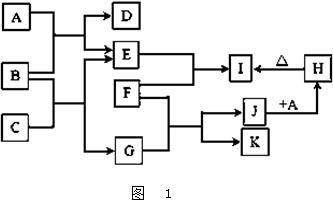 字母A~K各表示一种物质,其转化关系如下图所示,有的反应部分产物已略去.其中E、F、K为单质,其他均为化合物;A、E、K为无色气体,B为淡黄色固体,C为无色液体;F为常见的金属,高温下与某些金属氧化物反应是工业上冶炼金属的方法之一.试回答下列问题:
字母A~K各表示一种物质,其转化关系如下图所示,有的反应部分产物已略去.其中E、F、K为单质,其他均为化合物;A、E、K为无色气体,B为淡黄色固体,C为无色液体;F为常见的金属,高温下与某些金属氧化物反应是工业上冶炼金属的方法之一.试回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
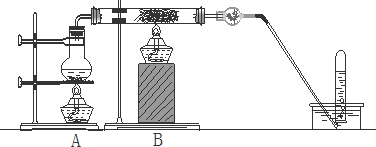
查看答案和解析>>
科目:高中化学 来源: 题型:
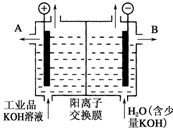 氢氧化钾是重要的工业产品.请回答:
氢氧化钾是重要的工业产品.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com