
| A. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$互为同位素 | |
| B. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的质量数相同 | |
| C. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$是同一种核素 | |
| D. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的核外电子数和中子数均为62 |
科目:高中化学 来源: 题型:解答题
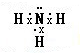 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为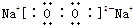 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为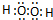 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:
一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
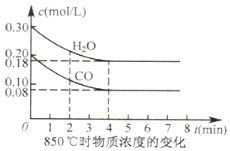 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用的实验仪器是容量瓶和烧杯 | |
| B. | 静置后所得液体上层呈紫红色 | |
| C. | 碘在CCl4中的溶解度比在水中的溶解度小 | |
| D. | 如果把CCl4加入碘的不饱和水溶液中,萃取碘的实验也可以成功 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
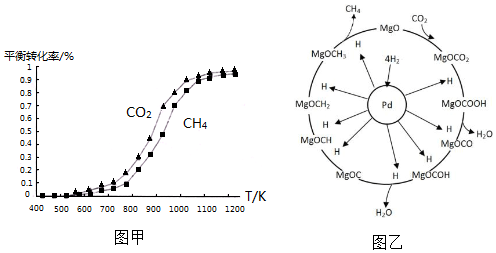 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
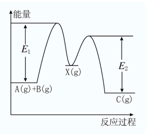 反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )| A. | △H=E1-E2 | B. | E1是反应①的活化能 | ||
| C. | X是反应A(g)+B(g)→C(g)的催化剂 | D. | △H2>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和溶液的密度$\frac{(a+b)}{V}$ | |
| B. | 饱和溶液的物质的量浓度$\frac{100a(M-18x)}{MV}$ | |
| C. | 25℃,R的溶解度$\frac{100a(M-18x)}{(bM+18ax)}$ | |
| D. | 饱和溶液的质量分数$\frac{a(M-18x)}{(a+b)M}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com