
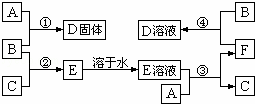
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E的溶液是无色的.请回答:
(1)A是Fe,B是Cl2,C是H2(请填写化学式);
(2)反应①的化学方程式 ;
(3)反应③的离子方程式 ;
(4)反应④的离子方程式 .
考点:无机物的推断;氯气的化学性质;铁的化学性质.
专题:推断题.
分析:B为黄绿色气体,应为Cl2,单质A是当今世界产量最大的金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,结合物质的相关性质解答该题.
解答: 解:B为黄绿色气体,应为Cl2,单质A是当今世界产量最大的金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,则
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe,Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2 2FeCl3,故答案为:2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2 2FeCl3;
2FeCl3;
(3)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣,故答案为:2Fe2++Cl2=2Fe3++2Cl﹣.
点评:本题考查无机物的推断,题目难度不大,本题注意根据物质的性质、特征作为突破口进行推断,学习中注意牢固把握元素化合物的性质,不要忽视物质的用途.


科目:高中化学 来源: 题型:
下列不同条件下的化学反应:A(aq)+B(aq)═C(aq)+D(aq)反应速率由大到小的顺序正确的是()
①常温下20mL溶液含A和B各0.001mol
②常温下100mL溶液含A和B各0.01mol
③常温下0.05mol/L A、B溶液各10mL混合后,再加水20mL
④常温下将100mL含A 0.001mol和20mL含B 0.001mol混合溶液混合.
A. ①②③④ B. ②③④① C. ②①③④ D. ②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
两份铝屑,第一份与足量盐酸反应,第二份与足量NaOH溶液反应,产生的氢气的体积比为1:2(相同状况下),则第一份与第二份铝屑的质量比为( )
A.1:l B.1:2 C.1:3 D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法中正确的是( )
|
| A. | 84g NaHCO3,晶体中含有NACO32﹣ |
|
| B. | 9.2g NO2和N2O4的混合气体中含有的氮原子数为0.2NA |
|
| C. | 标准状况下,11.2L臭氧中含NA个氧原子 |
|
| D. | 78g Na2O2与足量的CO2反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中表达正确的是( )
|
| A. | H、D、T表示同一种核素 | B. | F﹣原子结构示意图: |
|
| C. | 用电子式表示HCl形成过程 | D. | NaOH既含共价键又含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有H2O、NH3、CH4三种物质,它们分
别都含有1mol氢原子,则三种物质的物质的量之比为( )
A.1∶1∶1 B.6∶4∶3 C.4∶3∶2 D.6∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com