
 ,故答案为:5;2;1;5;1;1;1;
,故答案为:5;2;1;5;1;1;1;


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、钠和水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、二氧化硅与烧碱溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、金属铝溶于氢氧化钠溶液中:2Al+2OH-=2AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
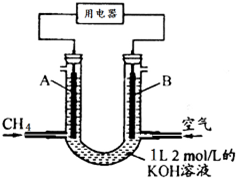 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法错误的是( )
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法错误的是( )| A、通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极 |
| B、0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+2KOH═K2CO3+3H2O |
| C、22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O═10HCO3- |
| D、V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com