
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色 | |
| B. | 在pH=3 的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
分析 A.氢氧化钠是强电解质,醋酸是弱电解质,在溶液中存在电离平衡,pH=11的NaOH溶液与pH=3的醋酸溶液中,醋酸浓度大于氢氧化钠,等体积混合酸有剩余;
B.pH=3的溶液呈酸性,次氯酸根离子与亚铁离子、氢离子反应;
C.常温下pH=7的溶液呈中性,则c(H+)=c(OHˉ),结合电荷守恒判断;
D.一水合氨是弱电解质,存在电离平衡,向氨水中加入醋酸铵,抑制一水合氨电离.
解答 解:A.pH=11的NaOH溶液与pH=3的醋酸溶液中,醋酸浓度大于氢氧化钠,等体积混合酸有剩余,溶液呈酸性,石蕊试液遇酸变红色,故A错误;
B.pH=3的溶液呈酸性,溶液中存在大量氢离子,Fe2+、H+与ClO-反应,在溶液中不能大量共存,故B正确;
C.常温下,pH=7的NH4Cl与氨水的混合溶液呈中性,则c(H+)=c(OH-),根据核电荷数可知:c(Cl-)=c(NH4+),溶液中离子浓度大小为:c(Cl-)=c(NH4+)>c(H+)=c(OH-),故C正确;
D.一水合氨是弱电解质,存在电离平衡,向氨水中加入醋酸铵,抑制一水合氨电离,溶液中氢氧根离子浓度减小,一水合氨浓度增大,所以氢氧根离子与一水合氨浓度的比减小,故D正确;
故选A.
点评 本题考查离子浓度大小比较、弱电解质的电离及离子共存等知识,题目难度中等,明确弱电解质电离特点、pH与氢离子浓度的换算、弱电解质电离程度与浓度的关系是解本题关键,试题培养了学生的分析能力及灵活应用能力.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | a与氢元素能形成原子个数之比为1:1的化合物 | |
| B. | b单质能与水、无水乙醇反应 | |
| C. | c3+与d-的最外层电子数和电子层数都不相同 | |
| D. | a与d可形成含有极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
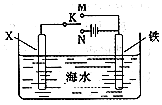 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数相同的元素都在同一族 | |
| B. | 同周期元素的电子层数都相同 | |
| C. | 同族元素的最外层电子数一定相同 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2A、NaHA两溶液中,离子种类不相同 | |
| B. | 在Na2A溶液中有:c(OHˉ)=c(HAˉ)+c(H2A)+c(H+) | |
| C. | 在NaHA溶液中有:c(Na+)+c(H+)=c(HAˉ)+2 c(A2ˉ)+c(OHˉ) | |
| D. | 在Na2A溶液中有:c(Na+)>c(A2ˉ)>c(H+)>c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 晶体硅熔点髙硬度大 | 可用于制作半导体材料 |
| B | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| C | NH4HCO3受热易分解 | 可用作氮肥 |
| D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com