
����Ŀ����ͭ��(CuFeS2)����ȡͭ���仯�������Ҫԭ��֮һ�������Ʊ������Ļ����
��1��ұ��ͭ�ķ�ӦΪ��8CuFeS2��21O2=8Cu��4FeO��2Fe2O3��16SO2����CuFeS2��Fe�Ļ��ϼ�Ϊ��2����Ӧ�б���ԭ��Ԫ����________����Ԫ�ط�����������Ӧ�������˱����22.4L���壬ת�Ƶĵ�����ĿΪ________��
��2������ұ�����̲�����������������SO2��Ϊ������Ⱦ��֮һ�����д��������к�������________�����������
a���߿��ŷ� b����Ũ������������������
c����NaOH��Һ������Na2SO3 d���ð�ˮ�����Ƶ������
��3�����������(K2S2O8)����ǿ�����ԣ��ɽ�I������ΪI2��S2O![]() ��2I��=2SO
��2I��=2SO![]() ��I2��ͨ���ı䷴Ӧ;����Fe3����Fe2�����ɴ�������Ӧ���������ӷ���ʽ��ʾFe3����������Ӧ���Ĺ��̣�________��________��������ƽ����
��I2��ͨ���ı䷴Ӧ;����Fe3����Fe2�����ɴ�������Ӧ���������ӷ���ʽ��ʾFe3����������Ӧ���Ĺ��̣�________��________��������ƽ����
��4�����û�ͭ��ұ��ͭ������¯��(��Fe2O3��FeO��SiO2��Al2O3)���Ʊ�Fe2O3������Ϊ��
����ϡ�����ȡ¯�������ˣ�
����Һ���������ټ������NaOH��Һ�����ˣ�������ϴ�ӡ�������յ�Fe2O3.
��������Ϣ�ش��������⣺
a����ȥAl3�������ӷ���ʽ��________��
b��ѡ���ṩ���Լ������ʵ����֤¯���к���FeO.
�ṩ���Լ���ϡ���ᡡϡ���ᡡKSCN��Һ��KMnO4��Һ��NaOH��Һ����ˮ ��ѡ�Լ�Ϊ________��֤��¯���к���FeO��ʵ������Ϊ____________________________________��
���𰸡� Cu��O 6.25NA cd 2Fe3����2I��=2Fe2����I2�� S2O![]() ��2Fe2��=2SO
��2Fe2��=2SO![]() ��2Fe3�� Al3����4OH��=AlO
��2Fe3�� Al3����4OH��=AlO![]() ��2H2O ϡ���� KMnO4��Һ ϡ�����ȡ¯��������ҺʹKMnO4��Һ��ɫ
��2H2O ϡ���� KMnO4��Һ ϡ�����ȡ¯��������ҺʹKMnO4��Һ��ɫ
����������1��8CuFeS2��21O2=8Cu��4FeO��2Fe2O3��16SO2�У���CuFeS2��Fe�Ļ��ϼ�Ϊ��2��FeԪ�صĻ��ϼ����ߣ�Cu��OԪ�صĻ��ϼ۽��ͣ���Cu��OԪ�ر���ԭ���ɷ���ʽͭ��16�ۣ�����21��4�ۣ�ÿ����16molSO2,ת�ƣ�16+21��4��mol=100mol���ӣ�����Ӧ�������˱����22.4L���壬ת�Ƶĵ�����ĿΪ100mol/16mol��NA =6.25NA ����2��a���߿��ŷţ���Ȼ�ŷ��ڿ����У���a����b��SO2������Ũ������������b����c��SO2�������������NaOH��Һ������Na2SO3 ����c��ȷ��d��SO2�������������Ӧ�����κ�ˮ���ð�ˮ�����Ƶ�����Σ���d��ȷ����ѡcd����3�����������������ԣ��ܽ�������������S2O82���ܽ���������������ԭ��Ϊ��2Fe3��+2I��=2Fe2��+I2��S2O82��+2Fe2��=2SO42��+2Fe3����
��4��a��������������������ܺ�ǿ���Լ�ǿ�Ӧ��6H��+Al2O3=3H2O+2Al3������ȥ�����ӵķ�Ӧ�����ù�������������Һ�������ӷ�Ӧ�������ǻ���������ȥAl3�������ӷ���ʽ�� Al3����4OH��=AlO![]() ��2H2O��b�����������Һ�������������ӣ�ʹ�ø��������Һ��ɫ�������Լ���ϡ������KMnO4��Һ��֤��¯���к���FeO��ʵ������Ϊ��ϡ�����ȡ¯��������ҺʹKMnO4��Һ��ɫ��
��2H2O��b�����������Һ�������������ӣ�ʹ�ø��������Һ��ɫ�������Լ���ϡ������KMnO4��Һ��֤��¯���к���FeO��ʵ������Ϊ��ϡ�����ȡ¯��������ҺʹKMnO4��Һ��ɫ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��ΪԪ�����ڱ�ǰ20��Ԫ�أ�X2-��Y�����Ӿ�����ͬ�ĵ��Ӳ�ṹ��������ȷ���ǣ�
A. ԭ�Ӱ뾶 X��YB. ���Ӱ뾶X2-��Y��
C. ������X��YD. �⻯����ȶ���H2X ��HY
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һС����Ƭ����ij������Һ�У���Ƭ��ȫ�ܽ⣬��������Һ�м����μ�NaOH��Һ������Al(OH)3����������NaOH��Һ����ı仯��ϵ��ͼ��ʾ������˵����ȷ����(����)
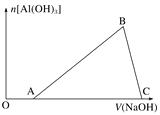
A. C�������ֻ��NaAlO2
B. ͼ��B��֮ǰ���������ӷ�ӦΪAl3����3OH��===Al(OH)3��
C. A��B�����ĵ�NaOH��Һ�����B��C�����ĵ�NaOH��Һ�����=3��1
D. �ܽ���Ƭ������Ũ����μӵ�NaOH��ҺŨ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ۺ�ͭ�ۻ�Ϸ�ĩ��Ϊȷ������ɣ����ṩ4mol/L��FeCl3��Һ��������Ʒ�ԣ���ij����ѧϰС��ͬѧ��ʵ�������£��ٶ���Ӧǰ����Һ������䣩�� ��
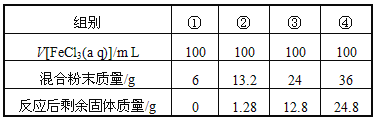
A. �������ַ�Ӧ����Һ��c��Fe3+��=2.0 mol/L
B. ������ʣ�������ͭ�������
C. �����鷴Ӧ�����Һ��c��Fe2+��=5 mol/L
D. ԭ��Ϸ�ĩ��n��Fe����n��Cu��=2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��������Ϊ2L�ĺ����ܱ������г���6molCO2��8mo1H2 �� ������Ӧ��CO2 ��g��+3H2��g��=CH3OH��g��+H2O��g����H=��49KJmol��1 �� ���n��H2�����ʵ�����ʱ��仯������I ��ʾ������˵����ȷ���ǣ� �� 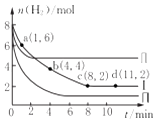
A.�÷�Ӧ��O��8min�ڵ�v��CO2��=0.125molL��1min��1
B.����ʼʱ�������г���3mo1CO2��4molH2 �� ��ƽ��ʱCH3OH�������������20%
C.����ʼʱ�������г���4mo1CO2��2molH2��2molCH3OH��1molH2O��g�������ʱ��Ӧv��������v���棩
D.����II������III�ı������ֱ��������¶ȡ���Сѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�����ת����ϵ����ͼ����֪A��һ�ֳ���������F��һ�ֺ��ɫ�������ش��������⡣

��1��A�Ļ�ѧʽΪ_______��
��2��ʵ���ұ���C��Һʱ�����������A��Ŀ����_____________________��B�����ᷴӦ�����ӷ���ʽΪ_____________________________��
��3������C��Һ�������ӳ��õķ�����______________________________��
��4��E����Һ�ڿ����л��������F����Ӧ����Ϊ_______________________________ ��
��5����C�м���Na2O2Ҳ��ʵ��C��D��F��ת����Na2O2��ȫ����ԭ����Ӧ�����ӷ���ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ���Ȼ�ѧ����ʽΪ��
1��C��s��+O2��g��=CO2��g����H1=��393.5kJ/mol
2��CH3COOH��l��+2O2��g��=2CO2��g��+2H2O��l����H2=��870.3kJ/mol
3��H2��g��+ ![]() O2��g��=H2O��l����H3=��285.8kJ/mol
O2��g��=H2O��l����H3=��285.8kJ/mol
��Ӧ2C��s��+2H2��g��+O2��g��=CH3COOH��l�� �ķ�Ӧ�ȣ��ʱ䣩Ϊ�� ��
A.+488.3kJ/mol
B.��488.3kJ/mol
C.��244.15kJ/mol
D.+244.15kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ba(OH)2����̬����CuSO4(��̬)��CH3COOH��Һ̬�����Թ�Ϊһ�࣬���������ʻ����Ժ����ǹ�Ϊһ�����
A. 75���ľƾ���Һ B. �����ƣ���̬�� C. Fe(OH)3 ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ⱦ������Ҫ��SO2�йص���
A. ˮ��B. ������ն�
C. ����D. ��ɫ��Ⱦ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com