
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 含4.9 g H2SO4与4.9 g H3PO4的混合溶液中氧原子数为0.4NA | |
| C. | 常温下,0.1 mol C2H4分子中含共用电子对数目为0.6NA | |
| D. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA |
分析 A.亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气;
B.磷酸和磷酸的摩尔质量相同为98g/mol,4.9g硫酸和磷酸物质的量相同,溶液中水分子也含氧原子;
C.1mol乙烯中含6mol共用电子对;
D.依据Ksp(BaSO4)=c(Ba2+)c(SO42-)计算离子浓度,结合溶液体积计算微粒数.
解答 解:A.1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故A错误;
B.含4.9 g H2SO4与4.9 g H3PO4的混合溶液中,磷酸和磷酸的摩尔质量相同为98g/mol,硫酸和磷酸物质的量相同为$\frac{4.9g}{98g/mol}$=0.05mol,水中也含有氧原子,则混合溶液中氧原子数大于0.4NA,
C.1mol乙烯中含6mol共用电子对,0.1 mol C2H4分子中含共用电子对数目为0.6NA,故C正确;
D.Ksp(BaSO4)=c(Ba2+)c(SO42-))=1×10-10,只能计算浓度,溶液体积不知不能计算微粒数,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算、氧化还原反应、分子结构、溶度积常数等知识点,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 符合CnH2n通式的烃属于烯烃 | |
| B. | 烷烃均能与氯水反应 | |
| C. | 甲烷、乙烯、乙炔可用在空气中燃烧的方法鉴别 | |
| D. | 具有同一通式的不同有机物互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O2-离子的结构示意图: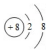 | |
| B. | 甲烷分子的比例模型: | |
| C. | 二氧化碳分子的电子式: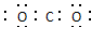 | |
| D. | 氮原子核外电子排布的轨道表示式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在透明的溶液中:Na+、K+、MnO4-、SO42- | |
| B. | pH>7的溶液中:Fe2+、Cu2+、SO42-、Cl- | |
| C. | 有SO42-存在的溶液中:K+、Mg2+、Ag+、NO3- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料的大量开发和使用是导致温室效应和形成酸雨的重要原因 | |
| B. | 为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI | |
| C. | 为了确保食品安全,应禁止使用食品添加剂 | |
| D. | 为了提高农作物产量,应该大量使用农药和化肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜电极应与X相连接 | |
| B. | H十透过质子交换膜由右向左移动 | |
| C. | 当N电极消耗0.25mol气体时,则铁电极增重16g | |
| D. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
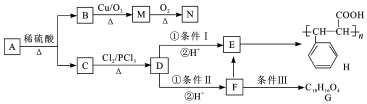
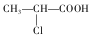 +HCl
+HCl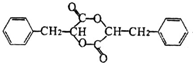 .
.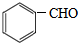 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$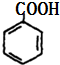 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.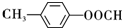 .
.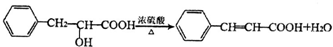 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
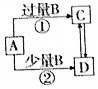
| A. | 若A为AlCl3溶液,B 可能为氨水,反应①的离子方程式为Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 若A为Fe,B可能为稀HNO3,反应②的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 若A为NaOH溶液,B可能为CO2,可用Ca(OH)2溶液鉴定C、D 溶液中的阴离子 | |
| D. | 若A为Cl2,B可能为NH3,实验室可用加热固体C的方法制取NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com