


 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
 在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )| A、该反应的化学方程式为2N?M |
| B、t1时,M的浓度是N浓度的2倍 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t2时,正、逆反应速率相等,化学反应达到了平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 请按以下要求,回答下列相应问题:
请按以下要求,回答下列相应问题:| 序号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解于酸的时间/s |
| 1 | 2 | 薄片 | 5 | 400 |
| 2 | 2 | 颗粒 | 5 | 500 |
| 3 | 2 | 薄片 | 15 | 200 |
| 4 | 2 | 薄片 | 25 | 100 |
| 5 | 2 | 薄片 | 35 | 50 |
| 6 | 2 | 颗粒 | 15 | t1 |
| 7 | 2 | 粉末 | 15 | t2 |
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
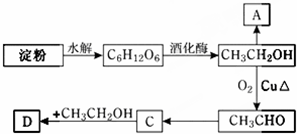
查看答案和解析>>
科目:高中化学 来源: 题型:
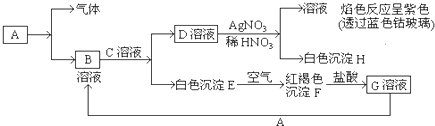
查看答案和解析>>
科目:高中化学 来源: 题型:
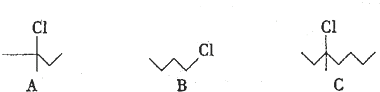
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L,x与y的关系如图所示.
某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L,x与y的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
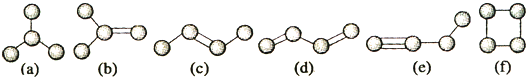
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com