
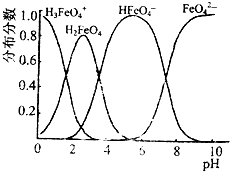
 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:

 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| A、工业制硫酸、工业制硝酸、由石英获取单晶硅变化均为氧化还原反应 |
| B、氧化反应与还原反应一定同时发生,但氧化剂、还原剂可不直接接触 |
| C、置换反应肯定都是氧化还原反应,但复分解反应可能是氧化还原反应 |
| D、氧化还原反应中氧化产物与还原产物不会再发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B、脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+ |
| C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D、金属的电化学腐蚀普遍存在,工业上经常用牺牲阳极的阴极保护法对金属进行保护,这是电解原理的一个重要应用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解Al2O3得到Al和O2 |
| B、石灰石高温分解为生石灰和二氧化碳 |
| C、铝粉与氧化铁高温反应 |
| D、Ba(OH)2?8H2O和NH4Cl晶体混合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
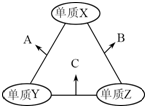 X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生右图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )
X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16.X、Y、Z三种元素的常见单质在适当条件下可发生右图所示变化,其中B和C均为10电子分子.下列说法不正确的是( )| A、X元素位于ⅥA |
| B、A不能溶解于B中 |
| C、B的沸点高于C的沸点 |
| D、A和C不可能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、一定温度下,1 L 0.50 mol?L-1NH4Cl溶液与2 L 0.25mol?L-1NH4Cl溶液含NH4+物质的量不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com