
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ������£�

��֪��
�ٺ�ˮ����Ԫ�أ���Br����ʾ����Ũ��0.068g/L��
��Br2�ķе�Ϊ59�棬����ˮ���ж��Ժ�ǿ��ʴ�ԣ�
��1����д�����ֺ�ˮ�����ķ�����_______________________��
��2����ˮ�������ӵ����ʵ���Ũ��Ϊ____________________��
��3����������ѻ�õ��ܶȵĺ�Br2��Һ����������ֽ�Br2��ԭΪBr����������ֵõ�Br2����Ŀ��Ϊ__________________��
��4���������SO2ˮ��Һ����Br2�������ʿɴ�95%���йط�Ӧ�����ӷ���ʽΪ_________��
��5����ҵ���ᴿ������������ʱ���ȷ�����ò���_____������װ�����������Ӿ��������������ܣ���ԭ����__________��
��6��Br2���л��ϳɹ�ҵ�е���Ҫԭ�ϣ��ױ���һ������ж��֣����б����ϵ�һ�ȴ���ֻ�����ֵĽṹ��ʽΪ_____________________��
���𰸡� �����������������ӽ����� 0.00085mol/L ������Ԫ�� Br2+SO2+2H2O�T4H++SO42��+2Br�� ˮԡ���� Br2��ʴ�� �ԣ�����ױ��Ľṹ��ʽ��
����������1����ˮ�����ķ����ж��֣���������������������ӽ������ȡ���2����ˮ����Ԫ�أ���Br����ʾ����Ũ��0.068g/L�������ʵ���Ũ��Ϊ��0.068��80��=0.00085mol/L����3������Ũ�ȵĺ�Br2��Һ��ԭΪBr�����ٽ�Br�������ֵõ�Br2����Ŀ��Ϊ������Ԫ�أ���4����SO2ˮ��Һ����Br2���йط�Ӧ�����ӷ���ʽΪBr2+SO2+2H2O��4H++SO42��+2Br������5��Br2�ķе�Ϊ59 �棬����ʱ���ȷ��������ˮԡ���ȣ�Br2��ʴ����������װ�����������Ӿ��������������ܡ���6���ױ���һ������ж��֣����б����ϵ�һ�ȴ���ֻ�����֣�˵���Ƕ�λ����ԭ�ӱ�ȡ�����ṹ��ʽΪ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������ȷ���� �� ��
A. ��ͬһ�����Ӳ����˶��ĵ��ӣ�����������϶���ͬ
B. �ӻ�����������γ���������������������δ����ɼ��ŵ��Ӷ�
C. ���ʵļ���Խ�����ʱ������е�����Խ��
D. �����ڱ���ԭ�ӵ�������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���Ӧ���������������С���� �� ��
A. ������̼ͨ��Na2O2��ĩ B. þ���ڶ�����̼��ȼ��
C. COͨ�����ȵ�CuO��ĩ D. ������Ͷ��CuSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У���֤�����ӵ����Լ������� ( )
A. ���ӵ�ˮ��Һ�м�������������Һ�����ɱ�����
B. �����ڿ��������ױ�����Ϊ�ۺ�ɫ
C. ��������Һ��ͨ�������̼����Һ�ɳ�������
D. ���ǵı�����Һ���ȱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ��Ҳ����Ҫ�Ļ���ԭ�ϡ�
��1����H2Ϊԭ����ȡ���������ϳ�CO(NH2)2�ķ�Ӧ���£�
N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ��H=179.38 kJ��mol1
��֪�� 2NH3(g)+CO2(g)===NH2CO2NH4(s) ��H=159.47 kJ��mol1
NH2CO2NH4(s) ===CO(NH2)2(s)+H2O(l) ��H=+72.49 kJ��mol1
��N2(g)+3H2(g) ===2NH3(g) ��H= kJ��mol1��
��2��������������ǵ�ǰ�о��ȵ㣬LiBH4��һ�����õĴ�����ϡ�������ĥ���Ʊ�Al��LiBH4�ĸ��ϲ��ϣ�����AlLiBH4��ϵ��ˮ��Ӧ��������Խ��������о���
��ͼ��Ϊ25��ˮԡʱÿ�˲�ͬ��ȵ�AlLiBH4���ϲ�����ˮ��Ӧ����H2�����ʱ��仯��ϵͼ����ͼ��֪������˵����ȷ�� (����ĸ)��
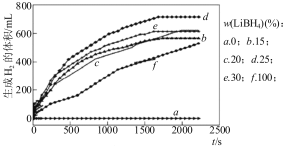

�� ��
a��25��ʱ����LiBH4��������ˮ��Ӧ��������
b��25��ʱ�����ϲ����������ܲ���������ֻ��������
c��25��ʱ��AlLiBH4���ϲ�����LiBH4����25%������Ч�����
��ͼ��Ϊ25����75��ʱ��AlLiBH4���ϲ���[��(LiBH4)=25%]��ˮ��Ӧһ��ʱ�������X��������ͼ��(X��������������ж�ij��̬�����Ƿ���ڣ���ͬ��̬���ʳ�������������Dz�ͬ)����ͼ������25��ʱAlLiBH4���ϲ�����LiBH4��ˮ��Ӧ���ɵ�LiB(OH)4��ѧ����ʽΪ ����Ԫ�صĴ����ж�����ʽ������Al(OH)3������ԭ������� ��
��3����֪H2S�����ȷֽ���H2�ķ�ӦΪ��H2S(g)![]() H2(g)+1/2S2(g)�ں����ܱ������������Ʋ�ͬ�¶Ƚ���H2S�ķֽ�ʵ������H2S����ʼŨ�Ⱦ�Ϊc mol��L1�ⶨH2S��ת�������������ͼ��ʾ��
H2(g)+1/2S2(g)�ں����ܱ������������Ʋ�ͬ�¶Ƚ���H2S�ķֽ�ʵ������H2S����ʼŨ�Ⱦ�Ϊc mol��L1�ⶨH2S��ת�������������ͼ��ʾ��

ͼ��aΪH2S��ƽ��ת�������¶ȹ�ϵ���ߣ�b���߱�ʾ��ͬ�¶��·�Ӧ������ͬʱ����δ�ﵽ��ѧƽ��ʱH2S��ת���ʡ���985��ʱ����Ӧ��t min�ﵽƽ������ʱH2S��ת����Ϊ40%����Ӧ����v(S2)= ���ú�c��t�Ĵ���ʽ��ʾ������˵�����¶ȵ����ߣ�����b������a�ƽ���ԭ�� ��
��4���ö��Ե缫���ú��Һ�ķ�����H2�ķ�ӦΪ��C(s)+2H2O(l) ===CO2(g)+2H2(g)�ֽ�һ������1 mol��L1 H2SO4��Һ������ú�۳�ֻ�ϣ��Ƴɺ�̼��Ϊ0.02 g��mL1��0.12g��mL1��ú��Һ��������ͼ��ʾװ���н��е�⣨���缫��Ϊ���Ե缫������B���ĵ缫��ӦʽΪ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)��ȡ����CH3COCH3���ֱ���0���20���£������ת����������Ӧ����ת��Ϊ��������ʵ����ͷ�Ӧ�������ʵ����ıȣ���ʱ��仯�Ĺ�ϵ���ߣ�Y��t������ͼ��ʾ������˵����ȷ����
CH3COCH2COH(CH3)2(l)��ȡ����CH3COCH3���ֱ���0���20���£������ת����������Ӧ����ת��Ϊ��������ʵ����ͷ�Ӧ�������ʵ����ıȣ���ʱ��仯�Ĺ�ϵ���ߣ�Y��t������ͼ��ʾ������˵����ȷ����

A. b����0����CH3COCH3��Y��t����
B. ��Ӧ���е�20minĩ��CH3COCH3��v (0��)/v(20��)�ı�ֵ����1
C. �����¶ȿ������̷�Ӧ�ﵽƽ���ʱ�䲢����߷�Ӧ��ת��Ϊ����������ʵ���
D. ��Y=0��Y=0.113��CH3COCH2COH(CH3)2�Ħ�n(0��)/��n(20��)�ı�ֵ����1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�������£�HNO2���뷴Ӧ��ƽ�ⳣ��ֵΪ2.6��10-4��NaNO2��һ����Ҫ��ʳƷ���Ӽ�����������ۼ�ζ������ʳ�ηdz����ƣ���ʳ��ҵ�������ʳ���ж����¼�ʱ�з�����
��1��ij�С��ͬѧ���ʵ�鷽������ NaCl��Һ��NaNO2��Һ������д���б���
ѡ��ҩƷ | ʵ������ | ����NaNO2������ |
�ٷ�̪��Һ | ____________ | ____________ |
�ڵ���-KI��ֽ | ____________ | ____________ |
��2�����������ж������������ŷţ�ʵ����һ�㽫���뱥���Ȼ����Һ����ʹ֮ת���������������ʣ������֮һΪ��ɫ��ζ���壬�������Ϊ____________���ѧʽ����
II���С��ͬѧ��������װ���Ʊ����ⶨ���ù������������ƣ�NaNO2��������������װ�ÿ��ظ�ʹ�ã����ּг�������ʡ�ԣ���

��֪�� ��2NO + Na2O2 ��2NaNO2��
�����������£�NO��NO2������MnO4����Ӧ����NO3����Mn2+��NaNO2��ʹ
���Ը��������Һ��ɫ��
��1��ʵ��װ�õ�����˳��Ϊ____________��
��2��Cƿ�ڷ�����Ӧ�����ӷ���ʽΪ____________��
��3��Ϊ�˲ⶨ�������Ƶĺ�������ȡ4.0g��Ʒ����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.10 mol��L��1������KMnO4��Һ���еζ���ʵ�������������±���
����� | 1 | 2 | 3 | 4 |
KMnO4��Һ���/mL | 20.60 | 20.02 | 20.00 | 19.98 |
�ٵ�һ��ʵ�����ݳ��ֽ������쳣������쳣��ԭ�������__________������ĸ��ţ���
a����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
b����ƿ������ˮϴ����δ����
c���۲�ζ��յ�ʱ���Ӷ���
�ڸ��ݱ������ݽ��м��㣬���ƵõĹ������������Ƶ���������Ϊ____________��
��4�����ʵ�飬�Ƚ�0.1mol��L��1NaNO2��Һ��NO2����ˮ��̶Ⱥ�0.1mol��L��1HNO2��Һ��HNO2����̶ȵ���Դ�С_______����Ҫ˵��ʵ�鲽�衢����ͽ��ۣ�������ҩƷ��ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶�Ϊ20�棬Ũ��Ϊ1.0mol��L��1��H2SO4��2.2mol��L��1�ļ���Һ��50ml���(��Һ�ܶȾ�Ϊ1g��ml��1��������Ϊ4.184kJ��K��1��kg��1)�������������������Һ���¶ȱ仯�������£�
��Ӧ�� | ��ʼ�¶�t1�� | ��ֹ�¶�t2�� |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3��H2O | 20 | 32.6 |
��ӦNH3��H2O ��l��![]() NH4+(aq)+OH��(aq)���ʱ�ԼΪ(��λ��kJ��mol��1) �� ��
NH4+(aq)+OH��(aq)���ʱ�ԼΪ(��λ��kJ��mol��1) �� ��
A. +2.1 B. +4.2 C. +52.7 D. ȱ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼���SO2���Ƿ���CO2�������ʣ����в�����ȷ����
A. ͨ��Ʒ����Һ��
B. ��ͨ��ˮ�У���ͨ�����ʯ��ˮ��
C. ��ͨ������KMnO4��Һ�У���ͨ�����ʯ��ˮ��
D. ͨ�����ʯ��ˮ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com