
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: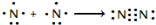 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
分析 (1)两个氮原子形成一个氮气分子;
(2)根据肼燃烧的方程式N2H4 (g)+O2(g)=N2(g)+2H2O(g),结合化学反应的实质是旧键的断裂、新键的形成来分析反应吸收和放出的热量,而△H=吸收的热量-放出的热量,然后根据H2O(l)=H2O(g)△H=+44kJ/mol来分析;
(3)KCN可用于溶解难溶金属卤化物.将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-和I-,据此写出离子方程式;而此反应的平衡常数表达式为K=$\frac{c(Ag(CN{)_{2}}^{-})×c({I}^{-})}{c(CN{-)}^{2}}$,然后根据Ksp(AgI)=1.5×10-16,K稳[Ag(CN)2-]=1.0×1021来分析.
(4)氨的催化氧化用于工业生产硝酸.在此反应中,氨气被氧化为NO在负极放电,结合环境为碱性分析;
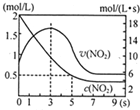
(5)①反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大;
②分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,结合转化率概念计算=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)两个氮原子形成一个氮气分子,故用电子式表示氮气的形成过程为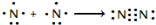 ,
,
故答案为: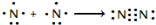 ;
;
(2)肼的燃烧反应为:N2H4 (g)+O2(g)=N2(g)+2H2O(g)
吸收能量:(4×390.8+193)KJ 497.3KJ 吸收热量:946KJ 462.8×4KJ
故△H=(4×390.8+193)KJ/mol+497.3KJ/mol-946KJ/mol-462.8×4KJ/mol=-543.7KJ/mol,故可知热化学方程式为:
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543.7KJ/mol ①
而H2O(l)=H2O(g)△H=+44kJ/mol ②
将①-②×2可知:N2H4 (g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol
故答案为:N2H4 (g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol;
(3)KCN可用于溶解难溶金属卤化物.将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-和I-,据此写出离子方程式为:AgI(s)+2CN-(aq)?Ag(CN)2-(aq)+I-(aq);
而此反应的平衡常数表达式为K=$\frac{c(Ag(CN{)_{2}}^{-})×c({I}^{-})}{c(CN{-)}^{2}}$,
而Ksp(AgI)=1.5×10-16=c(Ag+)•c(I-) ①
K稳[Ag(CN)2-]=1.0×1021=$\frac{c(Ag(CN{)_{2}}^{-})×c({I}^{-})}{c(CN{-)}^{2}}$ ②
将$\frac{①}{②}$可得此反应的平衡常数,故K=$\frac{c(Ag(CN{)_{2}}^{-})×c({I}^{-})}{c(CN{-)}^{2}}$=$\frac{{K}_{sp}(AgI)}{{K}_{稳}[Ag(CN{)_{2}}^{-}}$=$\frac{1.5×1{0}^{-16}}{1.0×1{0}^{21}}$=1.5×10-37,
故答案为:AgI(s)+2CN-(aq)?Ag(CN)2-(aq)+I-(aq);1.5×10-37;
(4)氨的催化氧化用于工业生产硝酸.在此反应中,氨气被氧化为NO在负极放电,结合环境为碱性可知电极反应为:NH3-5e-+5OH-=NO+4H2O,
故答案为:NH3-5e-+5OH-=NO+4H2O;
(5)①反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大,随反应进行二氧化氮浓度减小,反应为达到平衡,0-3s时v(NO2)增大是由于体系温度升高,
故答案为:容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大;
②分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,结合转化率概念计算=$\frac{消耗量}{起始量}$×100%=$\frac{1.5mol/L}{2mol/L}$×100%=75%,故答案为:75%.
点评 本题考查了图象分析判断,反应速率、转化率概念计算分析,平衡常数的计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量的KI溶液充分反应后,Kw(AgCl)减小 | |
| B. | 加入过量的KI溶液充分反应后,溶液中Ag+和I-的浓度之积等于Ksp(AgI) | |
| C. | 加入过量的KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积等于Ksp(AgCl) | |
| D. | Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0~6 min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1 | |
| B. | 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动 | |
| C. | 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)>T(15) | |
| D. | 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | C═O(CO2) | C═O(COS) | C═S | H-S | H-O |
| E(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入过量Na2CO3溶液:Na+、Ca2+、NH4+、NO3-、H+ | |
| B. | 加入适量NaHCO3溶液:Na+、Ca2+、NH4+、NO3-、HCO3- | |
| C. | 加入适量NaOH溶液:Na+、Ca2+、NH4+、NO3-、OH- | |
| D. | 加入过量FeSO4和稀硫酸:Fe2+、Fe3+、NH4+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极发生氧化反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解后,溶液中存在的金属阳离子只有Ni2+和Zn2+ | |
| C. | 电解后溶液中Ni2+数目减少 | |
| D. | 电解后,电解槽底部的阳极泥中有Pt和Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com