
用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是 ( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③
C.②③⑤③ D.①③⑤③
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.镁、铝具有一定的抗腐蚀性,是因为镁、铝不易被氧化
C.84消毒液的主要成分是NaClO
D.某些金属元素的焰色反应、海水提溴、煤的液化、石油的裂化都是化学变化的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性共价键和非极性共价键的是( )
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
查看答案和解析>>
科目:高中化学 来源: 题型:
铝热反应的本质是利用铝的还原性,将难熔金属从其氧化物中置换出来,关于铝热反应思考下列问题:
(1)是否所有的金属氧化物都能和铝发生铝热反应?
(2)在铝热反应中,镁条、KClO3的作用是________。
(3)做铝热反应时,应注意哪些事项?
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.无色溶液中:ClO-、MnO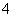 、Al3+、K+
、Al3+、K+
B.1.0 mol·L-1的Na[Al(OH)4]溶液中:Cl-、HCO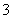 、K+、Ca2+
、K+、Ca2+
C.在强碱性环境中:[Al(OH)4]-、SiO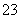 、Na+、K+
、Na+、K+
D.能使甲基橙显红色的溶液中:NH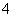 、[Al(OH)4]-、Na+
、[Al(OH)4]-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
MgSO4·7H2O是一种重要的化工原料。某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2杂质)制取MgSO4·7H2O的实验,流程如下。
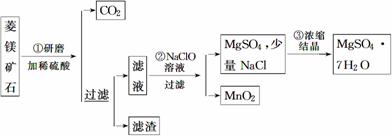
(1)第①步研磨的目的是____________________,所得滤液主要含__________________、__________________等溶质。
(2)第②步反应的离子方程式为_____________________________________________。
(3)第③步浓缩结晶后,要经过________、洗涤、干燥等步骤才可得到MgSO4·7H2O,洗涤沉淀的基本操作是______________________________________________________。
(4)若制得MgSO4·7H2O质量为82.00 g,测得MnO2质量为1.74 g,且测得第①步滤渣质量为4.70 g,忽略各物质在溶液中的溶解损失,可计算出菱镁矿石中MgCO3的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
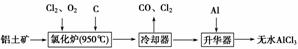
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为_____________________________
________________________________________________________________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为________________________________________________________________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________________________________________________________________________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
①写出上述除杂过程中涉及的离子方程式:______________________________、______________________________。
②AlCl3产品的纯度为__________。
(5)工业上另一种以铝灰为原料制备无水AlCl3的工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A、沸点大小关系为: 乙酸>水>乙醇>溴乙烷>甲醛
B、在水中溶解度大小关系为:乙酸异戊酯<苯酚<乙醇
C、用水可以区别苯、乙醛、四氯化碳、醋酸、硝基苯五种液体
D、甲醛、乙酸任意比混合,等质量的混合物完全燃烧耗氧量和生成CO2量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com