
 .
. 分析 (1)该有机物的相对分子质量为84,C的质量分数85.71%,H的质量分数14.29%,二者质量分数之和为100%,故该有机物属于烃,分子中C原子数目为$\frac{84×85.71%}{12}$=6、H原子的数目为$\frac{84-12×6}{1}$=12,故该有机物的分子式为C6H12;
(2)①A是链状化合物与氢气加成产物分子中有三个甲基,则加成产物为CH3CH2CH2CH(CH3)2、CH3CH2CH(CH3)CH2CH3,还原双键判断A可能的结构;
②B是链状化合物,1H-NMR谱中只有一个信号,则B中碳碳双键共连接4个甲基;
③C是环状化合物,1H-NMR谱中也只有一个信号,则C为环己烷.
解答 解:(1)该有机物的相对分子质量为84,C的质量分数85.71%,H的质量分数14.29%,二者质量分数之和为100%,故该有机物属于烃,分子中C原子数目为$\frac{84×85.71%}{12}$=6、H原子的数目为$\frac{84-12×6}{1}$=12,故该有机物的分子式为C6H12,故答案为:C6H12;
(2)①A是链状化合物与氢气加成产物分子中有三个甲基,则加成产物为CH3CH2CH2CH(CH3)2、CH3CH2CH(CH3)CH2CH3,CH3CH2CH2CH(CH3)2对应的烯烃有4种,CH3CH2CH(CH3)CH2CH3对应的烯烃有3种,故A可能的结构有7种,故答案为:7;
②B是链状化合物,1H-NMR谱中只有一个信号,则B中碳碳双键共连接4个甲基,则B的结构简式为(CH3)2C=C(CH3)2,故答案为:(CH3)2C=C(CH3)2;
③C是环状化合物,1H-NMR谱中也只有一个信号,则C为环己烷,结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查了有机物的推断、同分异构体等,关键是计算确定有机物分子式,(2)中①注意利用还原碳碳双键判断,难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| B. | 在反应KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3 mol Cl2转移电子数为6NA | |
| C. | SiO2与烧碱反应只生成盐和水,属于酸性氧化物 | |
| D. | 1 mol Cl2通入足量的水中,可生成1 mol HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用18.4 mol•L-1的硫酸 | B. | 升高溶液的温度 | ||
| C. | 向溶液中加入少量硝酸 | D. | 把锌粉换成锌块(片) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
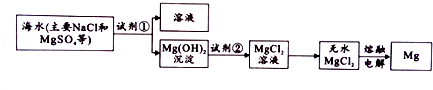
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
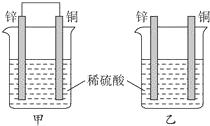
| A. | 两烧杯中溶液的pH值均增大 | B. | 产生气泡的速率甲比乙快 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲中铜片是正极,乙中锌片是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H(${\;}_{1}^{1}$H),D(${\;}_{1}^{2}$H),T(${\;}_{1}^{3}$H)表示三种氢原子 | |
| B. | 原子最外层少于4个电子的元素均是金属元素 | |
| C. | 稀有气体元素最外层电子数均为8个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com