
【题目】室温下,用相同浓度的NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的三种酸(HA、HB和HC)溶液,滴定的曲线如图所示,下列判断不正确的是

A.当中和百分数达50%时:![]()
B.滴定至①点时,溶液中:![]()
C.当中和百分数达100%时,消耗的NaOH溶液体积![]()
D.①和④所示溶液中都有:![]()
【答案】A
【解析】
浓度为0.1mol·L-1的一元酸,若为强酸,则c(H+)=0.1mol/L,pH=1,由图可知,浓度为0.1mol/L的HA、HB、HC的pH均大于1且pH依次增大,则三种酸均为一元弱酸,且酸性:HA>HB>HC,据此解答。
A.三种情况下分别存在着如下电荷守恒:c(A-)+c(OH-)=c(Na+)+c(H+)、c(B-)+c(OH-)=c(Na+)+c(H+)、c(C-)+c(OH-)=c(Na+)+c(H+),则c(Na+)=c(A-)+c(OH-)-c(H+)、c(Na+)=c(B-)+c(OH-)-c(H+)、c(Na+)=c(C-)+c(OH-)-c(H+),当中和百分数达50%时,三种溶液中的c(Na+)相等,那么:c(A-)+c(OH-)-c(H+)=c(B-)+c(OH-)-c(H+)=c(C-)+c(OH-)-c(H+),但是由于三种溶液的pH不相同,则三种溶液中c(OH-)-c(H+)不相等,故c(A-)、c(B-)、c(C-)不相等,A错误;
B.滴定至①点时,HC被中和一半,此时溶质为等物质的量的NaC和HC,二者都能电离C-,故c(C-)最大,其次是c(Na+),HC是弱酸,部分电离,故c(HC)第三大,溶液pH<7,c(H+)>c(OH-),综上所述,滴定至①点时,溶液中:![]() ,B正确;
,B正确;
C.HA、HB、HC都是一元弱酸,且浓度、体积均相等,则物质的量相等,所以,当中和百分数达100%时,消耗等浓度的NaOH溶液体积![]() ,C正确;
,C正确;
D.①和④所示溶液中都存在电荷守恒:![]() ,D正确。
,D正确。
答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】溴乙烷是无色油状液体沸点为38.4℃,难溶于水,能溶于多种有机溶剂.以NaBr固体、C2H5OH、浓H2SO4、水为原料,对反应后的混合液微热可在烧杯中得到粗产品(溴乙烷),反应装置如图(已略去夹持和加热装置),反应原理:①NaBr+H2SO4(浓)=NaHSO4+HBr;②CH3CH2OH+HBr![]() CH3CH2Br+H2O。下列有关说法正确的是( )
CH3CH2Br+H2O。下列有关说法正确的是( )

A.烧瓶中试剂加入的先后顺序:浓硫酸、水、溴化钠、乙醇
B.可用 装置代替倒置漏斗装置
装置代替倒置漏斗装置
C.冷凝水从b口进a口出
D.粗产品经水洗涤、蒸发结晶得到纯净的溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.离子半径(r):![]()
B.若存在简单阴离子![]() ,则X一定属于第ⅦA族元素
,则X一定属于第ⅦA族元素
C.S和Se属于第ⅥA族元素,H2S的还原性比H2Se的弱
D.元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是
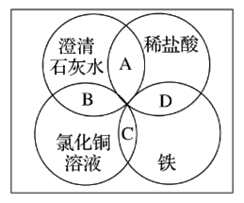
A. 复分解反应、复分解反应、化合反应、置换反应
B. 中和反应、置换反应、复分解反应、置换反应
C. 复分解反应、复分解反应、置换反应、置换反应
D. 分解反应、复分解反应、置换反应、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质。

(1)写出下列物质的化学式:A________、E________、F________、G________。
(2)按要求写方程式:
①A+B→C+D的化学方程式:_________________________________;
②F→G的化学方程式:________________________________________________;
③E→F的离子方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置及操作均正确的是

A. 图I中A盛放碳酸氢钠,B盛放碳酸钠,可对比二者的热稳定性
B. 图II可用于从NaCl溶液中提取NaCl晶体
C. 图III为实验室制备氨气的实验药品与发生装置
D. 图IV为实验室制备观察氢氧化亚铁的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表述不正确的是( )
A.电解CuCl2溶液:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
B.NaCl的形成过程:![]()
C.HCl在水中电离:HCl=H++Cl-
D.NH4Cl在水中发生水解:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍作为一种新兴材料日益被重视,是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。铍及其化合物大多具有毒性。如图是以一种已经预处理后的含铍矿绿柱石(主要含有![]() ,
,![]() ,
,![]() ,
,![]() 和
和![]() 等)为原料制取单质铍的工艺流程:
等)为原料制取单质铍的工艺流程:

已知:i.铍和铝的化学性质相似;
ii.氯化铍在融熔态时较难电离;
iii.Be(OH)2在![]() 时会溶解;
时会溶解;
iV.![]() 。
。
(1)滤渣1的主要成分是________。
(2)在“除铝”过程中铝会以铝铵矾![]() 的形式析出,则此过程中生成铝铵矾的化学方程式为________。
的形式析出,则此过程中生成铝铵矾的化学方程式为________。
(3)“除铁”过程要求不引入新的杂质,其操作应为________。
(4)在“沉铍”过程中,若改为加入过量的![]() 溶液,则铍的存在形式是________(填离子符号)。
溶液,则铍的存在形式是________(填离子符号)。
(5)在“分解”过程中产生的![]() 烟气会发生反应:
烟气会发生反应:![]() ,可用
,可用![]() 代替
代替![]() 用于雕刻玻璃,反应过程中有
用于雕刻玻璃,反应过程中有![]() 生成,请写出此反应的化学方程式:________。
生成,请写出此反应的化学方程式:________。
(6)工艺中采用氟化铍镁热还原法制取铍需要真空环境的原因是________。氯化铍熔盐电解法也可以制取铍,但是在电解过程中需要加入等量的![]() ,加入
,加入![]() 的作用是________。
的作用是________。
(7)铍铜因具有良好的导电性、导热性、耐腐蚀性、耐热冲击性以及无磁性、无火花等特性而成为最为广泛使用的一种铍合金。若绿柱石中![]() 的含量为a%,上述工艺流程中
的含量为a%,上述工艺流程中![]() 的产率为b%,则1t绿柱石理论上可以生产含2%Be的铍铜合金________t。
的产率为b%,则1t绿柱石理论上可以生产含2%Be的铍铜合金________t。
(8)工艺流程中产生的含有![]() 的废水可以用石灰中和——生物净化法进行净化。不同的pH值和温度下,石灰中和——生物净化法净化后溶液中的铍的浓度如图所示,则为了减少污染,最应选用的pH范围和温度分别是________(填序号)。
的废水可以用石灰中和——生物净化法进行净化。不同的pH值和温度下,石灰中和——生物净化法净化后溶液中的铍的浓度如图所示,则为了减少污染,最应选用的pH范围和温度分别是________(填序号)。
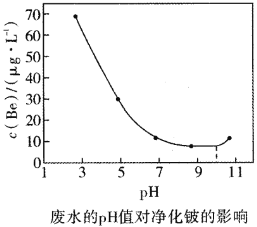
A.9~11,30℃ B.7~10,30℃ C.8~11,35℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com