
NA为阿伏加德罗常数,下列说法中正确的是( )
A.100mL 1mol·L-1AlCl3溶液中含的阳离子数等于0.1NA
B.标准状况下,22.4L CCl4中含有的CCl4分子数为NA
C.将2mL 0.5mol·L-lNa2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数为0.001NA
D.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去的电子数为0.1NA
科目:高中化学 来源: 题型:
将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如  图。(横坐标体积单位是mL,纵坐标质量单位是 g)求:
图。(横坐标体积单位是mL,纵坐标质量单位是 g)求:
(1)加入NaOH溶液0--20mL过程中反应方程式
为:_______________________。160--180mL过程中反应方程式为_______________________。
(2)合金中Mg的质量为____________g。所用HCl 的物质的量浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.SiO2是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中列出了25℃、1 01kPa时一些物质的燃烧热数据
01kPa时一些物质的燃烧热数据
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是
A.C≡C键能为796.0 kJ/mol
B.C—H键键长小于H—H键
C.2H2(g)+O2(g)=2H2O(g) △H=﹣571.6 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(
+3H2( g) △H=﹣376.4 kJ/mol
g) △H=﹣376.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2SO2(g)+O2(g)2SO3(g)
ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.0.1mol·L-1NaHCO3溶液中的粒子浓度:
c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)>c(H+)
B.将标况下2.24L的CO2通入150mL 1mol·L-1NaOH溶液中充分反应后的溶液:
2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH等于7,
则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
D.0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7 则反应后的 混合液:c(OH-)+2c(A-)=c(H+)+2c(HA) Z
混合液:c(OH-)+2c(A-)=c(H+)+2c(HA) Z
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,划线物质是还原剂的是( )
A.Zn+H2SO4===ZnSO4+H2↑
B.Cl2+2NaBr===2NaCl+Br2
C.C+CO2 2CO
2CO
D.Fe2O3+2Al 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。

(1)写出装置A中所发生反应的离子方程式________________。
(2)装置B中最适宜的试剂是________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:____________________________________。
(4)装置D中黑色固体为________(填名称),反应的化学方程式为______________________________。
(5)按照如图装置进行实验时,首先进行的操作是____________________________________。
(6)根据实验中的________________现象,可证明CO具有还原性,有关反应的化学方程式是______________________________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的________装置(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
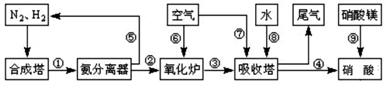
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
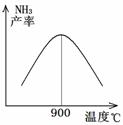
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com