
【题目】“类推思维”是化学解题中常用的思维方法,类推的结论最终要经过实践的检验,才能决定其正确与否。下列类推结论中正确的是
A.钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
B.铝在空气中生成氧化膜保护内层金属;铁在空气中生成氧化膜也保护内层金属
C.Al(OH)3、Cu(OH)2受热易分解;Fe(OH)3受热也易分解
D.Fe与CuSO4溶液反应能置换Cu;Na与CuSO4溶液反应也能置换Cu
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语或物质的性质描述正确的是( )
A. 乙烯在一定条件下能发生加成反应,加聚反应,被酸性高锰酸钾溶液氧化
B. 符合分子式为C3H8O的醇有三种不同结构
C. 如图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷![]()
D. 治疗疟疾的青蒿素(如图)易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺(NH2Cl,Cl的化合价为+1价)是一种长效缓释有机氯消毒剂,它与水可以发生复分解反应。有关氯胺的说法错误的是
A.氯胺中的氮元素为-3价
B.氯胺与水反应的产物为NH2OH和HCl
C.氯胺的消毒原理与漂粉精相似
D.氯胺的消毒效率(单位质量的消毒剂得到的电子数)是Cl2的1.38倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备合成氨原料气过程中存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ·mol-1,下列判断正确的是
CO2(g)+H2(g) △H=-41kJ·mol-1,下列判断正确的是
A. 该反应的逆反应是放热反应B. 反应物总能量小于生成物总能量
C. 反应中生成22.4LH2(g),放出41kJ热量D. 反应中消耗1mol CO(g),放出41kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。


下列关于原电池和干电池的说法不正确的是
A. 两者正极材料不同
B. MnO2的放电产物可能是KMnO4
C. 两者负极反应式均为Zn失电子
D. 原电池中Zn与稀H2SO4存在自放电现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探索二氧化碳在海洋中转移和归宿,是当今海洋科学研究的前沿领域。研究表明,溶于海水的二氧化碳主要以无机碳形式存在,其中HCO3-占95%。科学家利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

下列说法不正确的是
A. a室中OH-在电极板上被氧化
B. b室发生反应的离子方程式为:H+ + HCO3- = CO2↑ + H2O
C. 电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
D. 若用氢氧燃料电池供电,则电池负极可能发生的反应为:H2 + 2OH- - 2e- =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | 33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为_______。
(2)用甲装置制氯气,MnO4 被还原为Mn2+,该反应的离子方程式为________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到_______(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;②__________。
(4)如果缺少乙装置,丁装置中可能产生SnCl2杂质,产生SnCl2杂质的化学方程式为______,以下试剂中可用于检测是否产生SnCl2的有_____
A.H2O2溶液 B.FeCl3溶液(滴有KSCN) C.AgNO3溶液 D.溴水
(5)己装置的作用是_____。
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.35gSnCl4,则SnCl4的产率为____(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=___________。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H=______________;
2CO(g)+2H2(g) 的△H=______________;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是___________________________________;
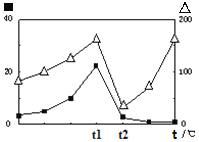 (代表CO的生成速率,■代表催化剂的催化效率)
(代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向__________(填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式:_____________;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,体积为11.2L 的SO2所含O原子数为__________。
(2)9g水与_________g硫酸所含的分子数相等,它们所含氧原子数之比是__________。
(3)在2H2S+SO2===2H2O+3S反应中氧化产物与还原产物的物质的量之比为__________。
(4)氯气有毒,实验室常用NaOH溶液吸收多余的氯气,反应的离子方程式为
______________________________;将少量的CO2通入次氯酸钙溶液中发生反应的离子方程式为__________________________________________________________________________;
(5) 配平下列化学方程式___NH3 + ___O2 === ___NO + ___H2O
(6) 请在下列化学方程式上用双线桥法标出电子转移的方向和数目 8NH3 + 3Cl2 === 6NH4Cl + N2__________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com