
在不同条件下分别测得2SO2+O2⇌2SO3的化学反应速率,其中表示该反应进行最快的是( )
|
| A. | υ(SO2)=4 mol/(L•min) | B. | υ(O2)=0.1 mol/(L•s) |
|
| C. | υ(O2)=3mol/(L•min ) | D. | υ(SO2)=0.1 mol/(L•s) |
考点:
反应速率的定量表示方法.
专题:
化学反应速率专题.
分析:
首先换算为相同的单位,以SO2为标准,利用速率之比等于化学计量数之比都转化为用SO2用表示的速率进行比较.
解答:
解:A、υ(SO2)=4 mol/(L•min);
B、υ(O2)=0.1 mol/(L•s)=6 mol/(L•min),速率之比等于化学计量数之比,所以υ(SO2)=2υ(O2)=2×6 mol/(L•min)=12 mol/(L•min);
C、υ(O2)=3mol/(L•min),速率之比等于化学计量数之比,所以υ(SO2)=2υ(O2)=2×3mol/(L•min)=6mol/(L•min);
D、υ(SO2)=0.1 mol/(L•s)=6 mol/(L•min);
故反应速率由快到慢的顺序为:B>C=D>A;
故选B.
点评:
考查反应速率快慢的比较,难度不大,注意选择某一物质为标准,都转化该物质表示的反应速率进行比较.


科目:高中化学 来源: 题型:
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为 ;B和N相比,电负性较大的是 ,BN中B元素的化合价为 ;
(2)在BF3分子中,F﹣B﹣F的键角是 ,B原子的杂化轨道类型为,BF3和过量NaF作用可生成NaBF4,BF4﹣的立体结构为 ;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 ,层间作用力为 ;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g•cm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B⇌3C+4D中,表示该反应速率最快的是( )
|
| A. | υ(A)=0.5mol•L﹣1•S﹣1 | B. | υ(B)=0.3 mol•L﹣1•S﹣1 |
|
| C. | υ(C)=0.8mol•L﹣1•S﹣1 | D. | υ(D)=1 mol•L﹣1•S﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2+O2⇌2SO3测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是关于反应A2(g)+3B2(g)⇌2C(g)△H<0的平衡移动图形,影响平衡移动的原因是( )
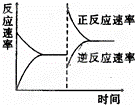
|
| A. | 升高温度,同时加压 |
|
| B. | 降低温度,同时减压 |
|
| C. | 增大反应物浓度,同时减小生成物浓度 |
|
| D. | 增大反应物浓度,同时使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | HCl溶液中无OH﹣ |
|
| B. | NaOH溶液中无H+ |
|
| C. | KCl溶液中既无OH﹣也无H+ |
|
| D. | 常温下,任何物质的水溶液中都有H+和OH﹣,且Kw=1×10﹣14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
可确认发生了化学平衡移动的是( )
|
| A. | 化学反应速率发生了改变 |
|
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 |
|
| C. | 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
|
| D. | 可逆反应达到平衡后,使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
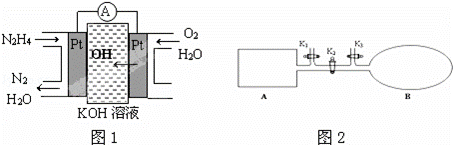
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
(1)肼燃料电池原理如图1所示,左边电极上发生的电极反应式为 .
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=﹣67.7kJ•mol﹣1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534.0kJ•mol﹣1
2NO2(g)⇌N2O4(g)△H=﹣52.7kJ•mol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: .
(3)如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
①B中可通过 判断可逆反应2NO2⇌N2O4已经达到平衡.
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为 L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com