
分析 (1)欲配制480mL 0.1mol•L-1 Na2CO3溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,依据m=CVM计算需要溶质的质量;
(2)依据配制步骤选择仪器;
(3)分析操作对溶质的物质的量和溶液体积的影响,根据c=$\frac{n}{V}$进行误差分析.
解答 解:(1)实验室欲配制480mL 0.1mol/L Na2CO3溶液,需要选用500mL的容量瓶,需要碳酸钠的物质的量为:0.5L×0.1mol/L=0.5mol,需要十水碳酸钠晶体的物质的量为0.05mol,质量为:286g/mol×0.05mol=14.3g,
故答案为:14.3;
(2)溶液配制操作步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,
所以需要的仪器为:托盘天平、500mL容量瓶、胶头滴管、玻璃棒、烧杯、量筒、钥匙,
玻璃仪器有:500mL容量瓶、胶头滴管、玻璃棒、烧杯、量筒,
故答案为:500mL容量瓶;胶头滴管;
(3)A.容量瓶内壁附有水珠而未干燥处理,对溶液的体积和溶质的物质的量都不产生影响,溶液浓度不变,故A不选;
B.忘记将洗涤液加入容量瓶,导致溶质的物质的量偏小,溶液浓度偏低,故B选;
C.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故C不选;
D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切,导致溶液体积偏大,溶液浓度偏高;
故D选;
故选:BD.
点评 本题考查了配制一定物质的量浓度的溶液的方法,明确原理,熟悉配置步骤和仪器的使用是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 等于15% | B. | 大于15% | C. | 小于15% | D. | 无法估计 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与H2SO4反应:Fe+2H+=Fe3++H2↑ | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 氢氧化钡溶液与稀H2SO4 反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | NaHCO3溶于稀盐酸中:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
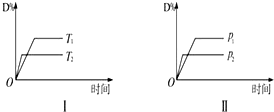 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )| A. | 升高温度,平衡正移 | |
| B. | 使用催化剂,D的百分含量增加 | |
| C. | m<p+q | |
| D. | B的颗粒越小,反应速率越快,有利于平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/L Na2CO3溶液中含有的CO32-数目为0.1 NA | |
| B. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| C. | 常温常压下,将0.1mol氯气通入水中发生化学反应,转移电子数为0.2 NA | |
| D. | 常温常压下,0.1 mol甲烷含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com