
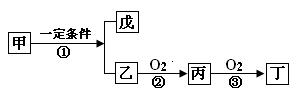
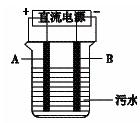
 乙物质为燃料的微生物燃料电池结构示意图如图所示,该原电池的负极反应方程式为
乙物质为燃料的微生物燃料电池结构示意图如图所示,该原电池的负极反应方程式为 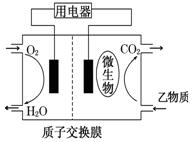
科目:高中化学 来源:不详 题型:填空题
 ,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________________。
,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________________。
 (3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子含未成对电子最多的第二周期元素 | B.原子最外层电子排布为2s22p4的元素 |
| C.位于周期表中第三周期ⅢA族的元素 | D.原子最外层电子排布为3s23p3的元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| a | | b | |||||||||||||||
| | | | | | | | | | | | | | c | d | | | |
| e | f | g | h | | | i | | ||||||||||
| | | | | | | | | j | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
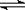 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____ __ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____ __ (填序号) 。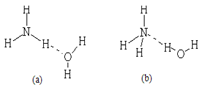
| | 锂 | X | Y |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
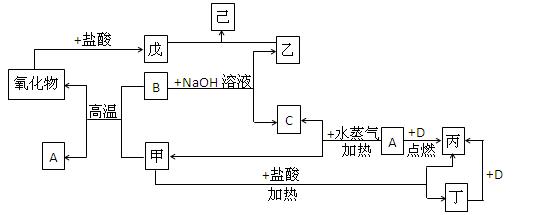
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 液反应,其化学式为_▲_。
液反应,其化学式为_▲_。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 DE2(
DE2( g)+A2(g),
g)+A2(g),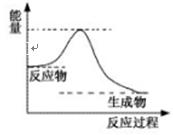
 化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=
化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=  。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com