
【题目】(1)研究氯气跟金属的反应时,选用金属铜进行实验。用坩埚钳夹住一束铜丝,灼热后立刻放入充满氯气的集气瓶里。铜丝燃烧后把少量水注入集气瓶里,用玻璃片盖住瓶口,振荡。
①根据哪些实验现象可判断铜丝燃烧后生成了+2价铜的化合物:_______________。
②反应的化学方程式为______________________________________________________。
(2)研究浓硫酸的强氧化性时,选用金属铜跟浓硫酸进行实验,实验装置如下图所示。
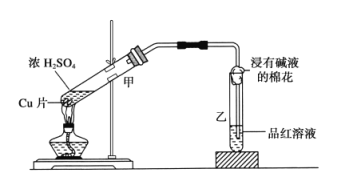
①乙中的现象_______,试管中的浸有碱液的棉花的作用是____________。
②甲中的反应方程式为_____________________________________。
(3)上述两个实验为什么都选金属铜作样本来进行实验________。
A.铜是一种不活泼金属
B.选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况
C.铜是一种常见金属
D.铜跟氯气或浓硫酸反应可生成有色溶液,现象明显
【答案】燃烧时产生棕色烟,加水振荡后得到蓝绿色溶液 ② Cu+Cl2![]() CuCl2 品红溶液褪色 防止SO2逸出污染空气 Cu+2H2SO4(浓)
CuCl2 品红溶液褪色 防止SO2逸出污染空气 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O ABCD
CuSO4+SO2↑+2H2O ABCD
【解析】
(1)①根据铜与氯气的反应现象及生成固体溶于水后溶液变成蓝色分析;
②铜与氯气在点燃条件下反应生成氯化铜;
(2)①二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫为污染气体,需要用氢氧化钠溶液吸收多余的二氧化硫;
②甲中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(3)根据铜为常见金属且性质不活泼,与氯气、浓硫酸反应后生成物溶于水形成有色溶液等方面考虑。
(1)①铜在氯气中燃烧的现象为:铜丝剧烈燃烧,产生大量棕黄色的烟,加水后形成了蓝绿色溶液,证明反应生成了+2价的铜,
故答案为:燃烧时产生棕色烟,加水振荡后得到蓝绿色溶液。
②铜与氯气反应生成氯化铜,反应的化学方程式为:Cu+Cl2![]() CuCl2,
CuCl2,
故答案为:Cu+Cl2![]() CuCl2。
CuCl2。
(2)①二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫有毒,多余的气体不能直接排放,需要用氢氧化钠溶液吸收SO2气体,防止空气污染,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,
故答案为:品红溶液褪色;防止SO2逸出污染空气。
②甲中铜与浓硫酸在加热条件下反应生成二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(3)由于铜是一种不活泼金属,选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况,铜又是一种常见金属及铜跟氯气或浓硫酸反应可生成有色溶液,现象明显,所以选金属铜作样本来进行实验,故A、B、C、D正确。
故答案为:ABCD。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应是为了更好的利用化学反应。回答下列问题:
(1)在①置换反应 ②化合反应 ③分解反应 ④复分解反应四种基本反应类型中,一定属于氧化还原反应的是____(填标号)。
(2)在下列反应中:K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O,___是氧化剂,___元素被氧化,___是还原产物,___是氧化产物。用双线桥标明电子转移的方向和数目:____。
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Cl2(g)![]() 2HCl(g)的反应能量变化示意图如下。下列说法不正确的是
2HCl(g)的反应能量变化示意图如下。下列说法不正确的是

A. 键的断裂过程是吸热过程,键的形成过程是放热过程
B. “假想的中间物质”的总能量高于起始态H2和Cl2的总能量
C. 反应的△H=[(a+b)-2c]kJ/mol
D. 点燃条件和光照条件下,反应的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林的结构简式如右图: 
根据这一信息,回答下列问题:。
(1) 写出阿司匹林的分子式:______________________________________
(2) 根据结构,推测阿司匹林的性质,下列试剂中,不能与阿司匹林反应的是 (_______)
A、氢氧化钠溶液 B、硫酸钠溶液 C、碳酸钠溶液 D、稀硫酸
(3) 阿司匹林是一种人工合成药物,化学上用水杨酸与乙酸酐(CH3CO)2O反应来制取阿司匹林。请用化学反应方程式表示这个过程:__________________________________________________________
(4)阿司匹林与NaOH反应可以得到可溶性钠盐,有比阿司匹林更好的疗效。请写出此反应的方程式:__________________________________________________________
(5) 有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱。请回答:
①某同学胃酸过多,应选用的药物是________(填序号)。
抗酸药是治疗胃酸过多的一类药品,请写出一种抗酸药与胃酸反应的化学方程式:_________________________________________________________
②由于具有兴奋作用,国际奥委会严禁运动员服用的药物是________(填序号)。
③从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是________(填序号)。
④滥用药物会导致不良后果,如过量服用________(填序号)会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然气、石油和煤的综合利用,下列说法错误的是
A.可燃冰是一种新型洁净能源B.石油裂化是为了提高轻质油的产量
C.煤的干馏属于物理变化D.以煤、石油、天然气为原料可生产三大合成材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com