
| A. | 1000mL,117g | B. | 950mL,111.2 g | C. | 任意规格,117g | D. | 500mL,111.2g |
分析 容量瓶的规格为:50,100 mL、250 mL、500 mL和1000 mL等多种.因此只能配制一定体积的溶液,没有950mL的容量瓶,可配制1000mL 2mol/L的NaCl溶液,取出950mL使用.计算溶质时也按1000mL来计算.
解答 解:实验中需2mol/L的NaCl溶液950mL,但实验室没有规格为950mL的容量瓶,为了减小误差,故我们应选用1000ml的容量瓶,故实际配置溶液体积为1000ml,故应称量NaCl的质量为:1L×2mol/L×58.5g/mol=117g.
故选A.
点评 只能配制容量瓶上规定体积的溶液,不能配制任意体积的一定物质的量浓度的溶液.计算时也要按配制的体积来计算所需溶质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
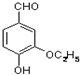 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.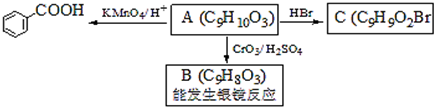
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).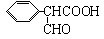 .
.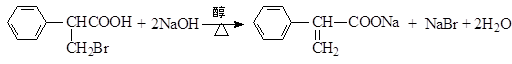 .
.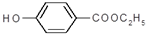 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用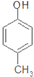 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
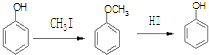
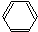 $→_{H_{2},△}^{催化剂}$
$→_{H_{2},△}^{催化剂}$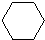 $→_{Br_{2}}^{光照}$
$→_{Br_{2}}^{光照}$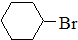
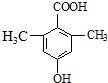 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用18.4 mol•L-1的硫酸 | B. | 升高溶液的温度 | ||
| C. | 向溶液中加入少量硝酸 | D. | 把锌粉换成锌块(片) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
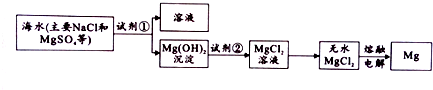
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | Ca(HCO3)2溶于稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 铁与H2SO4反应:Fe+2H+═Fe3++H2↑ | |
| D. | 澄清的石灰水与醋酸反应:OH-+CH3COOH═CH3COO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com