
| A. | MnO2→Mn2+ | B. | PCl3→PCl5 | C. | HCl→H2 | D. | H2O2→O2 |
科目:高中化学 来源: 题型:选择题

| A. | ③④⑦⑧ | B. | ①②③④ | C. | ⑤⑥⑦⑧ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 静电除尘 | |
| B. | 一支钢笔用不同牌子的两种墨水,易堵塞 | |
| C. | 氯化铁溶液加入碳酸钠溶液出现红褐色沉淀 | |
| D. | 河水和海水交界处形成三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
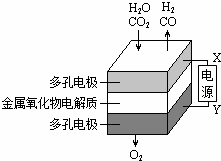 在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ=H2+O2ˉ | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
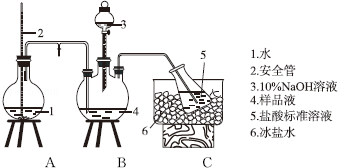
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
如图表示反应X(g)?4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )| A. | X的平衡转化率为85% | |
| B. | 第6 min 后,反应就终止了 | |
| C. | 若升高温度,X的平衡转化率将大于85% | |
| D. | 若降低温度,v正减小,v逆增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
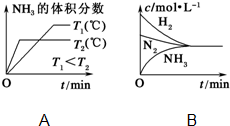 已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:
已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 | |
| B. | 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 | |
| C. | 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 | |
| D. | 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com