
| A. | Na2O2、Fe3O4、CuO均为碱性氧化物 | B. | 盐酸、水玻璃、氨水均为混合物 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 稀豆浆、硅酸、氯化铁溶液均为胶体 |
分析 A.和酸反应生成盐和水的氧化物为碱性氧化物;
B.一种物质组成的为纯净物,不同物质组成的为混合物;
C.水溶液中或熔融状态下导电的化合物为电解质;
D.根据胶体的概念及胶粒大小进行判断.
解答 解:A.和酸反应生成盐和水的氧化物为碱性氧化物,Fe3O4、CaO均为碱性氧化物,Na2O2和酸反应生成盐和水同时生成氧气,不是碱性氧化物,故A错误;
B.盐酸是氯化氢的水溶液、水玻璃是硅酸钠的水溶液、氨水为氨气的水溶液均为混合物,故B正确;
C.烧碱、冰醋酸水溶液中导电均为电解质,四氯化碳不能电离为非电解质,故C错误;
D.稀豆浆、硅酸粒子直径在1-100nm之间均为胶体,氯化铁溶液不是胶体,故D错误;
故选B.
点评 本题考查混合物、电解质、非电解质、酸性氧化物、碱性氧化物胶体等概念的理解和应用,题目难度不大,注意这几个概念的区别.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂属于天然高分子化合物,在碱性条件下水解可制得肥皂 | |
| B. | 在一定条件下,氨基酸之间能发生反应合成多肽 | |
| C. | 在淀粉水解液中加入氢氧化钠,再加入碘水,溶液未变蓝,说明淀粉己完全水解 | |
| D. | 蛋白质溶液中加入Na2SO4浓溶液有固体析出,加入足量水后固体不溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -48.5kJ/mol | B. | +48.5kJ/mol | C. | -45.5kJ/mol | D. | +45.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸银溶液产生白色沉淀,一定有Cl- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.025mol | C. | 4.9g | D. | 9.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

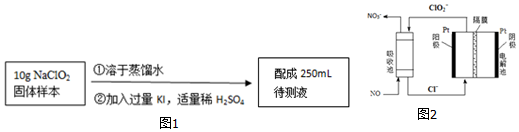
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠中含2NA个O2- | |
| B. | 0.1molOH-含NA个电子 | |
| C. | 1.8g重水(D2O)中含NA个中子 | |
| D. | 标准状况下11.2L臭氧中含NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100 g质量分数为30%的甲醛水溶液中,含有氢原子数为2NA | |
| B. | 7.8 g Na2S和Na2O2固体混合物中,含有的阴离子数为0.1NA | |
| C. | 1mol乙醇含有共价键的总数7NA | |
| D. | 反应2SO2(g)+O2(g)?2 SO3 (g),单位时间内消耗NA个O2分子的同时生成2NA个SO3分子,此时反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 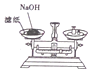 称取一定量的NaOH | |
| B. | 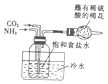 制取NaHCO3 | |
| C. | 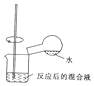 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 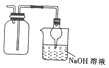 收集NO2丙防止其污染环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com