
 |  |  |  |
| A.熬药后箅渣 | B.防雾霾戴口罩 | C.制作玫瑰精油 | D.森林中的丁达尔效应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.是过滤操作;
B.防雾霾戴口罩能防止稀硝颗粒物被吸入;
C.装置是蒸馏过程;
D.森林中的丁达尔效应是胶体微粒对对光的散射作用;
解答 解:A.是过滤操作,利用的是不容易水的物质被过滤,得到滤液,与分散质粒子直径有关,故A不选;
B.防雾霾戴口罩能防止稀硝颗粒物被吸入,和微粒直径大小有关,故B不选;
C.装置是蒸馏过程,利用的是物质沸点不同可知温度蒸馏得到馏分,与分散质粒子直径无关,故C选;
D.森林中的丁达尔效应是胶体微粒对对光的散射作用,属于胶体的特征性质,和胶体微粒直径有关,故D不选;
故选C.
点评 本题考查了现象分析和实验操作的过程分析判断,主要是胶体性质和蒸馏过程的理解,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
 香豆素-4是一种激光染料,应用于可调谐染料激光器.香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示.下列有关叙述正确的是( )
香豆素-4是一种激光染料,应用于可调谐染料激光器.香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示.下列有关叙述正确的是( )| A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊变红色的溶液:K+、Fe2+、SO42-、NO3- | |
| B. | 0.1 mol•L-1NaHCO3溶液:K+、Ba2+、CO32-、Cl- | |
| C. | c(OH-)/c(H+)=l0-12的溶液:K+、Al3+、Cl-、Br- | |
| D. | 由水电离出的c(H+)=l0-12mol•L-1的溶液:Mg2+、K+、Br-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M室发生的电极反应式为:2H2O-4e-=O2↑+4H+ | |
| B. | N室中:a%<b% | |
| C. | b膜为阴离子交换膜 | |
| D. | 理论上每生成1mol产品,阴极室可生成5.6L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ⅰ的烧杯中立即产生红褐色沉淀 | B. | Ⅱ的试管中溶液变红 | ||
| C. | Ⅲ的试管中放出大量气体 | D. | Ⅳ的试管中先出现白色沉淀后消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 使用药品 | 现象 |
| Ⅰ | Na2O2、H2O | ①试管壁发热 ②有无色无味气体产生 |
| Ⅱ | Na2O2、浓盐酸 | ①试管壁发热 ②有刺激性气味的气体产生 ③反应后所得溶液呈浅黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
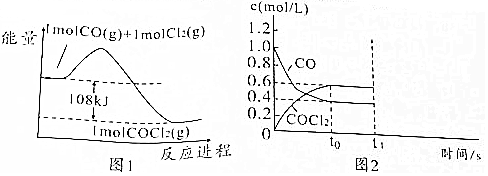
 ;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;
;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com